题目内容
17.在5L的密闭容器中,1molA和3molB在一定条件下反应:A(g)+4B(g)?2C(g),2min后反应达到平衡,生成0.4molC,计算:(1)B的平均反应速率;
(2)A的转化率;
(3)平衡时B的体积分数.
分析 1molA和3molB在一定条件下反应:A(g)+4B(g)?2C(g),2min后反应达到平衡,生成0.4molC,则
A(g)+4B(g)?2C(g)
开始 1 4 0
转化 0.2 0.8 0.4
平衡 0.8 3.2 0.4
结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$、体积分数=$\frac{平衡的量}{平衡时气体的总物质的量}$计算.
解答 解:1molA和3molB在一定条件下反应:A(g)+4B(g)?2C(g),2min后反应达到平衡,生成0.4molC,则
A(g)+4B(g)?2C(g)
开始 1 4 0
转化 0.2 0.8 0.4
平衡 0.8 3.2 0.4
(1)B的平均反应速率为$\frac{\frac{0.8mol}{5L}}{2min}$=0.08mol/(L.min),答:B的平均反应速率为0.08mol/(L.min);
(2)A的转化率为$\frac{0.2mol}{1mol}$×100%=20%,答:A的转化率为20%;
(3)平衡时B的体积分数为$\frac{3.2}{0.8+3.2+0.4}$×100%=72.7%,答:平衡时B的体积分数为72.7%.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率、体积分数的计算方法等为解答的关键,侧重分析与计算能力的考查,注意体积分数与物质的量分数的关系,题目难度不大.

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案| A. | 饱和NaHCO3溶液 | B. | 饱和Ca(HCO3)溶液 | C. | CuSO4稀溶液 | D. | FeCl2溶液 |
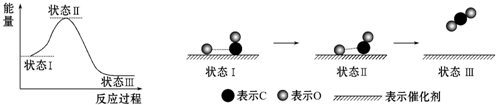
下列说法中正确的是( )
| A. | CO和O生成CO2是吸热反应 | B. | 状态Ⅰ→状态Ⅲ表示CO和O反应的过程 | ||
| C. | CO和O生成了具有非极性键的CO2 | D. | 在该过程中,CO断键形成C和O |
| X | Y | ||
| Z | W | M |
(1)请写出元素名称:X碳Y氮W氯;
(2)元素Z位于周期表中第三周期ⅢA族;
(3)写出X单质与Y的最高价氧化物水化物浓溶液在受热时反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;M的最高价氧化物的水化物化学式为HClO4.
X、Y、Z、W、J是元素周期表前四周期中的五种常见元素.其相关信息如下表:
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
(2)元素Y位于元素周期表第三周期第VIA族;
(3)元素Z的原子最外层共有7种不同运动状态的电子;基态Z原子中,电子占有的最高能层符号为3p;
(4)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1,W的基态原子核外价电子排布图是
 ;
;(5)元素Y与元素Z相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bce;
a.常温下,Y的单质与Z的单质状态不同
b.Z的电负性大于Y
c.Z的氢化物比Y的氢化物稳定
d.在反应中,Y原子得电子数比Z原子得电子数多
e.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
(6)J的元素名称氮,在周期表中位于p区.写出J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐的离子方程式NH3+H+=NH4+.
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.6mol/(L•min) | ||
| C. | v(C)=0.5mol/(L•min) | D. | v (D)=0.45mol/(L•min) |
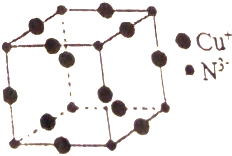 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用.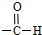 )碳原子的杂化方式为sp2;乙醇的沸点明显高于乙醛,其主要原因为乙醇分子间存在氢键.
)碳原子的杂化方式为sp2;乙醇的沸点明显高于乙醛,其主要原因为乙醇分子间存在氢键.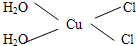 .
.