题目内容
18.将0.195g锌粉加入20.0mL的0.100mol•L-1MO2+溶液中,恰好完全反应,则还原产物可能是M2+.分析 n(Zn)=$\frac{0.195g}{65g/mol}$=0.003mol,n(MO2+)=0.02L×0.1mol/L=0.002mol,Zn失去电子,M得到电子,结合电子守恒计算.
解答 解:n(Zn)=$\frac{0.195g}{65g/mol}$=0.003mol,n(MO2+)=0.02L×0.1mol/L=0.002mol,
Zn失去电子,M得到电子,设还原产物中M的化合价为x,
由电子守恒可知,0.003mol×(2-0)=0.002mol×(5-x),
解得x=2,则生成M2+,
故答案为:M2+.
点评 本题考查了氧化还原反应,为高频考点,侧重考查学生的分析能力和计算能力,明确反应方程式中元素化合价变化是解本题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.有以下六种原子:${\;}_{3}^{6}$Li、${\;}_{3}^{7}$Li、${\;}_{11}^{23}$Na、${\;}_{12}^{24}$Mg、${\;}_{6}^{14}$C、${\;}_{7}^{14}$N,下列相关说法不正确的是.
| A. | ${\;}_{3}^{6}$Li和${\;}_{3}^{7}$Li在元素周期表中所处的位置相同 | |
| B. | ${\;}_{6}^{14}$C和${\;}_{7}^{14}$N质量数相等,二者互为同位素 | |
| C. | ${\;}_{11}^{23}$Na和${\;}_{12}^{24}$Mg的中子数相同但不属于同种元素 | |
| D. | ${\;}_{3}^{7}$Li的质量数和${\;}_{7}^{14}$N的中子数相等 |
9.给定条件下,下列选项中所示的物质间转化,不能均满足一步实现的是( )
| A. | SO2$\stackrel{Ca(OH)_{2}}{→}$CaSO3$→_{△}^{O_{2}}$CaSO4 | |
| B. | CO2(g)+H2O(g)$→_{叶绿素}^{光}$O2$\stackrel{放电}{→}$O3 | |
| C. | 石油$\stackrel{分馏}{→}$C2H4$\stackrel{催化剂}{→}$ | |
| D. | NaCl水溶液$→_{(惰性电极)}^{通电}$NaOH溶液$\stackrel{Al(OH)_{3}}{→}$NaAlO2 |
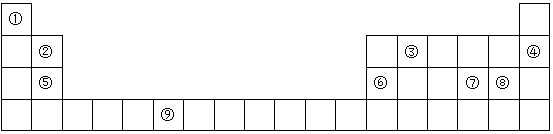
6.如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )

| A. | 常压下5种元素的单质中Z单质的熔点最高 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | Y元素的非金属性比W元素的非金属性强 | |
| D. | W的氢化物的还原性比Y的氢化物的还原性弱 |
13.生活中碰到的某些问题,常常涉及到化学知识,下列分析正确的是( )
| A. | 氯气和二氧化硫均可做漂白剂,若同时使用它们漂白-湿润物质,漂白效果会更好 | |
| B. | 为消除碘缺乏病,卫生部规定食盐必须加碘,其中碘以单质形式存在 | |
| C. | 工业酒精不能勾兑美酒,因其中含有甲醇,饮后会造成人的双目终生失明 | |
| D. | 淀粉、纤维素和油脂都属于天然高分子化合物 |
11.下列反应的离子方程式书写正确的是( )
| A. | 石灰石与稀盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ | |
| C. | 氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH-=Fe(OH)3↓ | |
| D. | 稀硝酸溶液与铜反应:Cu+4H++NO3-=Cu2++2H2O+NO↑ |
8.下列物质性质与应用对应关系正确的是( )
| A. | 乙烯能发生加聚反应,可用于制塑料 | |
| B. | 硝酸具有酸性,可用于实验室制氢气 | |
| C. | 氨气易溶于水,可作制冷剂 | |
| D. | 蛋白质遇CuSO4溶液发生凝聚,可用于提纯蛋白质 |