题目内容
1.在水溶液 里或熔融状态下能够导电的化合物叫做电解质.电解质溶液之所以能够导电,是由于它们在溶液中发生了电离,产生了离子.电离时生成的阳 离子全部是氢离子 的化合物叫做酸;生成的阴离子 离子全部是氢氧根 的化合物叫做碱;生成金属阳离子或铵根离子 和酸根离子 的化合物叫做盐.分析 电解质是溶于水溶液中或在熔融状态下就能够导电(电解离成阳离子与阴离子)的化合物;
酸碱电离理论由阿伦尼乌斯提出,在水溶液中电离出的阳离子全部是氢离子的化合物叫做酸,在水溶液中电离出的阴离子全部是氢氧根离子的化合物叫做碱;在水溶液中电离出酸根离子和金属阳离子的化合物为盐,据此分析.
解答 解:根据电解质定义可知,电解质是指在水溶液中或熔融状态下能够导电的化合物,例如酸、碱和盐等.电解质溶液之所以能够导电,是由于它们在溶液中发生了电离,产生了离子.酸碱电离理论由阿伦尼乌斯提出,在水溶液中电离出的阳离子全部是氢离子的化合物叫做酸,在水溶液中电离出的阴离子全部是氢氧根离子的化合物叫做碱,阳离子是金属离子或铵根离子、阴离子是酸根离子的化合物为盐,故答案为:水溶液;熔融状态;电离;离子;阳;氢离子;阴离子;氢氧根;金属阳离子或铵根离子;酸根离子.
点评 本题考查了电解质与非电解质、酸碱盐的判断,题目难度不大,注意掌握电解质与非电解质、酸碱盐的概念及其判断方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案
相关题目
17.下列各组离子中,能在强酸性溶液中能大量共存的是( )
| A. | Na+、K+、Ca2+、HCO3- | B. | OH-、Cl-、Na+、NH${\;}_{4}^{+}$ | ||
| C. | Cu2+、Na+、SO42-、Cl- | D. | Mg2+、Na+、Cl-、CH3COO- |
9.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
| A. | 14 g乙烯和丙烯混合气体中的氢原子数为2NA | |
| B. | 1 molN2与4 mol H2反应生成的NH3分子数为2NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA |
16.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量减小6.5 g |
13.在已处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡移动的是( )
| A. | 反应混和物各组分的浓度 | B. | 反应物的转化率 | ||
| C. | 正、逆反应速率 | D. | 反应混和物的压强 |

 ⑧
⑧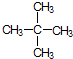 ⑨C60
⑨C60