题目内容
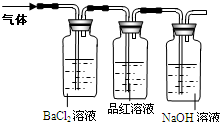 工业上常通过高温分解FeSO4的方法制备Fe2O3,但同时有污染环境的气体产生,为搞清这种气体的组成,进行如下的探究:
工业上常通过高温分解FeSO4的方法制备Fe2O3,但同时有污染环境的气体产生,为搞清这种气体的组成,进行如下的探究:
【科学假设】FeSO4高温分解后产生的气体几种可能是________,________,________
这一推测的科学依据是运用了________定律
【探究实验】将FeSO4高温分解产生的气体通入右下图所示的装置中
【实验现象】①BaCl2溶液中出现白色沉淀②品红溶液逐渐褪色
【实验结论】①FeSO4高温分解后产生的气体是________;②FeSO4高温分解的化学反应;方程式是________
【实验反思】实验操作中将通过品红溶液的气体再通入NaOH溶液的目的是________.
SO2 SO3 SO2和SO3 质量守恒 SO2和SO3 2FeSO4 Fe2O3+SO2↑+SO3↑ 吸收尾气,防止对环境的污染
Fe2O3+SO2↑+SO3↑ 吸收尾气,防止对环境的污染
分析:FeSO4在高温条件下分解生成Fe2O3和含硫氧化物,可根据实验现象判断生成的气体成分,SO2有毒,污染空气,实验室中应用NaOH溶液处理.
解答:根据质量守恒定律可知,FeSO4在高温条件下分解生成Fe2O3,同时生成含硫氧化物,
可能为:SO2、SO3或SO2和SO3,加入BaCl2溶液中出现白色沉淀,说明生成SO3,品红溶液逐渐褪色,说明生成SO2,
则说明生成物应为SO2和SO3,则反应方程式为2FeSO4 Fe2O3+SO2↑+SO3↑,SO2有毒,污染空气,实验室中应用NaOH溶液处理.
Fe2O3+SO2↑+SO3↑,SO2有毒,污染空气,实验室中应用NaOH溶液处理.
故答案为:SO2、SO3、SO2和SO3;质量守恒;SO2和SO3;2FeSO4 Fe2O3+SO2↑+SO3↑;吸收尾气,防止对环境的污染.
Fe2O3+SO2↑+SO3↑;吸收尾气,防止对环境的污染.
点评:本题考查二氧化硫的性质以及制备实验方案的设计,题目难度中等,注意把握物质的性质,结合实验现象进行分析和判断,该类题目牢固把握相关基础知识,一般不会出错.
 Fe2O3+SO2↑+SO3↑ 吸收尾气,防止对环境的污染
Fe2O3+SO2↑+SO3↑ 吸收尾气,防止对环境的污染分析:FeSO4在高温条件下分解生成Fe2O3和含硫氧化物,可根据实验现象判断生成的气体成分,SO2有毒,污染空气,实验室中应用NaOH溶液处理.
解答:根据质量守恒定律可知,FeSO4在高温条件下分解生成Fe2O3,同时生成含硫氧化物,
可能为:SO2、SO3或SO2和SO3,加入BaCl2溶液中出现白色沉淀,说明生成SO3,品红溶液逐渐褪色,说明生成SO2,
则说明生成物应为SO2和SO3,则反应方程式为2FeSO4
 Fe2O3+SO2↑+SO3↑,SO2有毒,污染空气,实验室中应用NaOH溶液处理.
Fe2O3+SO2↑+SO3↑,SO2有毒,污染空气,实验室中应用NaOH溶液处理.故答案为:SO2、SO3、SO2和SO3;质量守恒;SO2和SO3;2FeSO4
 Fe2O3+SO2↑+SO3↑;吸收尾气,防止对环境的污染.
Fe2O3+SO2↑+SO3↑;吸收尾气,防止对环境的污染.点评:本题考查二氧化硫的性质以及制备实验方案的设计,题目难度中等,注意把握物质的性质,结合实验现象进行分析和判断,该类题目牢固把握相关基础知识,一般不会出错.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
 工业上常通过高温分解FeSO4的方法制备Fe2O3,但同时有污染环境的气体产生,为搞清这种气体的组成,进行如下的探究:
工业上常通过高温分解FeSO4的方法制备Fe2O3,但同时有污染环境的气体产生,为搞清这种气体的组成,进行如下的探究: 绿矾是一种重要的化工原料.
绿矾是一种重要的化工原料.


