��Ŀ����
����Ŀ�������仯������Tũҵ����������Ҫ������
(1)![]() �ڿ��������տ��Ƶ���ϵ��������ϡ���֪
�ڿ��������տ��Ƶ���ϵ��������ϡ���֪![]() ��101kPaʱ��
��101kPaʱ��
![]()
![]()
![]()
![]()
д��![]() �ڿ�������������
�ڿ�������������![]() ���Ȼ�ѧ����ʽ______
���Ȼ�ѧ����ʽ______
(2)�����г���CO��ԭ����������ұ������Tҵ�Ͽ����ü�����ˮ������Ӧ�Ʊ�COԭ������![]() ����ͼ��
����ͼ��![]() ��
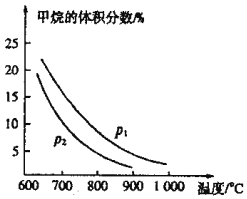
��![]() ��ʼ�����Ϊ1��3ʱ������ϵ�м��������������¶ȡ�ѹǿӰ��Ĺ�ϵͼ��
��ʼ�����Ϊ1��3ʱ������ϵ�м��������������¶ȡ�ѹǿӰ��Ĺ�ϵͼ��
�ټ�����ˮ������Ӧ�Ʊ�CO�ķ�ӦΪ______![]() ��������������������
��������������������![]() ��Ӧ��ѹǿ
��Ӧ��ѹǿ![]() ______
______![]() ����
����![]() ������
������![]() ��
��![]()
���ں��º�ѹ�������£�������Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ijһ�����������б仯��˵��ƽ��һ�����淴Ӧ�����ƶ�����______
A.�淴Ӧ������������С
B.���������ܶȼ�С
C.��ѧƽ�ⳣ��Kֵ��С
D.ˮ������ת���ʼ�С
���ں��¡����ݵ������£�������ƽ����ϵ�г��������Ϊ��3�ļ�����ˮ����������壬�ٴδﵽƽ��ʱCO���������______![]() ��������������С������������
��������������������������![]() ��
��
(3)��֪![]() ʱ��
ʱ��![]() �����¶��·�Ӧ
�����¶��·�Ӧ![]() ��ƽ�ⳣ��
��ƽ�ⳣ��![]() ______
______
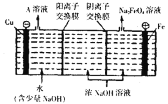
(4)��ҵ��ͨ�����ŨNaOH��Һ���Ʊ�![]() ��Ȼ��ת��Ϊ
��Ȼ��ת��Ϊ![]() �����ԭ����ͼ��ʾ����A��Һ�����ʵijɷ�Ϊ______
�����ԭ����ͼ��ʾ����A��Һ�����ʵijɷ�Ϊ______![]() �ѧʽ
�ѧʽ![]() �������ĵ缫��ӦʽΪ______
�������ĵ缫��ӦʽΪ______
 .
.
���𰸡�![]() ����
���� ![]() AC ��С
AC ��С ![]() NaOH
NaOH ![]()
��������
![]() �����֪��Ӧ�����ݸ�˹���ɣ���д�Ȼ�ѧ����ʽ��
�����֪��Ӧ�����ݸ�˹���ɣ���д�Ȼ�ѧ����ʽ��
![]() �ٸ���ͼ���֪���¶�Խ�ߣ�������������Խ�ͣ����ڴ˷�Ӧ����������ʵ�������ķ�Ӧ��ѹǿ����ƽ�����ƣ������������������
�ٸ���ͼ���֪���¶�Խ�ߣ�������������Խ�ͣ����ڴ˷�Ӧ����������ʵ�������ķ�Ӧ��ѹǿ����ƽ�����ƣ������������������
��A���淴Ӧ������������С��˵����Ӧ������У�
B�����������������䣬���ܶȼ�С��˵�����������������
C����ѧƽ�ⳣ��Kֵ��С��ƽ�����ƣ�
D������ˮ����Ũ�ȣ�ƽ�����ƣ�ˮ������ת����Ҳ���С��
���ں��¡����ݵ������£�������ƽ����ϵ�г��������Ϊ��3�ļ�����ˮ����������壬�൱�ڽ���������ѹ����
![]() ����ƽ�ⳣ���ĸ����Ϸ�Ӧд������ʽ����ƽ��Ũ�ȵõ���
����ƽ�ⳣ���ĸ����Ϸ�Ӧд������ʽ����ƽ��Ũ�ȵõ���
![]() �缫�������������ϵ缫��ӦʽΪ
�缫�������������ϵ缫��ӦʽΪ![]() ��ŨNaOH��Һ��������ͨ�������ӽ���Ĥ���������ң�������Feʧ���Ӻ�
��ŨNaOH��Һ��������ͨ�������ӽ���Ĥ���������ң�������Feʧ���Ӻ�![]() ��Ӧ����
��Ӧ����![]() ��
��
![]() ���ݸ�˹���ɣ�����Ӧ��
���ݸ�˹���ɣ�����Ӧ��![]() ����
����![]() ����
����![]() ����
�У���![]() �ɵ��ȷ�Ӧ����ʽΪ
�ɵ��ȷ�Ӧ����ʽΪ![]() ��
��
![]() �ٸ���ͼ���֪���¶�Խ�ߣ�������������Խ�ͣ��������¶ȣ�ƽ�����ƣ���˷�ӦΪ���ȷ�Ӧ�����ڴ˷�Ӧ����������ʵ�������ķ�Ӧ��ѹǿ����ƽ�����ƣ��������������Խ��
�ٸ���ͼ���֪���¶�Խ�ߣ�������������Խ�ͣ��������¶ȣ�ƽ�����ƣ���˷�ӦΪ���ȷ�Ӧ�����ڴ˷�Ӧ����������ʵ�������ķ�Ӧ��ѹǿ����ƽ�����ƣ��������������Խ��![]() ��
��
��A���淴Ӧ������������С��˵���ı䷴Ӧ����������Ӧ����������Ӧ������У����淴Ӧ�����ɼ�С����A��ȷ��
B�����������������䣬���ܶȼ�С��˵���������������������Ӧ�����������������ķ���ƽ�����ƣ���B����
C����ѧƽ�ⳣ�� ��Kֵ��С��˵��ƽ�����ƣ���C��ȷ��
��Kֵ��С��˵��ƽ�����ƣ���C��ȷ��
D������ˮ����Ũ�ȣ�ƽ�����ƣ�ˮ������ת����Ҳ���С����ˮ������ת���ʼ�С��һ����ƽ���������𣬹�D����
�ʴ�AC��
���ں��¡����ݵ������£�������ƽ����ϵ�г��������Ϊ��3�ļ�����ˮ����������壬�൱�ڽ���������ѹ������ƽ�����ƣ����ٴδﵽƽ��ʱCO�������������С��
![]() ����Ӧ
����Ӧ![]() ��ƽ�ⳣ��
��ƽ�ⳣ��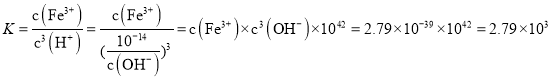 ��
��
![]() �缫�������������ϵ缫��ӦʽΪ
�缫�������������ϵ缫��ӦʽΪ![]() ��ŨNaOH��Һ��������ͨ�������ӽ���Ĥ���������ң�������������Һ������ΪNaOH��������Feʧ���Ӻ�
��ŨNaOH��Һ��������ͨ�������ӽ���Ĥ���������ң�������������Һ������ΪNaOH��������Feʧ���Ӻ�![]() ��Ӧ����
��Ӧ����![]() ���缫��ӦʽΪ
���缫��ӦʽΪ![]() ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ������ʵ�������Ԥ��ʵ��Ŀ�Ļ�����ʵ�����һ�µ���![]()
ѡ�� | ʵ����� | ʵ��Ŀ�Ļ���� |
A | �������� | ��ȥ |
B | ��ij��Һ�м��� | ֤����Һ�к� |
C | ��ij��Һ�м���ϡ���ᣬ�ų���ɫ��ζ���壬������ͨ�����ʯ��ˮ��ʯ��ˮ����� | ֤������Һ�д��� |
D | �� | ֤�� |
A.AB.BC.CD.
����Ŀ���±���25��ʱijЩ�ε�Ũ�Ȼ�����������ĵ���ƽ�ⳣ��������˵����ȷ����
��ѧʽ | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp��Ka | Ksp=1.8��10-10 | Ksp=2.0��10-12 | Ka=1.8��10-5 | Ka=3.0��10-8 | Ka1=4.1��10-7 Ka2=5.6��10-11 |
A. ��ͬŨ��CH3COONa��NaClO�Ļ��Һ�У�������Ũ�ȵĴ�С��ϵ��c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. ��Ũ�Ⱦ�Ϊl��10-3mol/L��KCl��K2CrO4���Һ�еμ�l��10-3mol/LAgNO3��Һ��CrO42-���γɳ���
C. ̼������Һ�еμ�������ˮ�����ӷ���ʽΪCO32-+Cl2+H2O=HCO3-+Cl-+HClO
D. ��0.1mol/LCH3COOH��Һ�еμ�NaOH��Һ��c(CH3COOH):c(CH3COO-)=5:9����ʱ��ҺpH=5