题目内容
有A、B、C、D、E、F六种短周期元素,原子序数依次增大.已知A的一种核素的原子核为质子,B原子的最外层电子数是次外层电子数的2倍.B原子的最外层电子数是D、E原子最外层电子数之和,C原子的最外层电子数是D、F原子最外层电子数之和.下列推论不正确的是( )
| A、A、B两元素能形成多种化合物 |
| B、D、E两元素的最高价氧化物对应的水化物可相互反应 |
| C、C的气态氢化物的稳定性一定大于F的气态氢化物 |
| D、C、F两种元素可以形成化合物 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:有A、B、C、D、E、F六种短周期元素,原子序数依次增大,
A的一种核素的原子核为质子,则A是H元素;
B原子的最外层电子数是次外层电子数的2倍,原子的最外层电子数不超过8个,所以其次外层为K层,则B原子的L层是最外层,L层电子数是4,所以B是C元素;
B原子的最外层电子数是D、E原子最外层电子数之和,D和E的原子序数大于B,所以D、E属于第三周期元素,D的原子序数小于E,所以D是Na元素、E是Al元素;
C的原子序数大于B而小于D,且C原子的最外层电子数是D、F原子最外层电子数之和,C是N或O或F或Ne元素,如果C是N元素,则F是Si元素,如果C是O元素,则F是P元素,如果C是F元素,则F是S元素,如果C是Ne元素,则F是Cl元素.
A的一种核素的原子核为质子,则A是H元素;
B原子的最外层电子数是次外层电子数的2倍,原子的最外层电子数不超过8个,所以其次外层为K层,则B原子的L层是最外层,L层电子数是4,所以B是C元素;
B原子的最外层电子数是D、E原子最外层电子数之和,D和E的原子序数大于B,所以D、E属于第三周期元素,D的原子序数小于E,所以D是Na元素、E是Al元素;
C的原子序数大于B而小于D,且C原子的最外层电子数是D、F原子最外层电子数之和,C是N或O或F或Ne元素,如果C是N元素,则F是Si元素,如果C是O元素,则F是P元素,如果C是F元素,则F是S元素,如果C是Ne元素,则F是Cl元素.
解答:
解:有A、B、C、D、E、F六种短周期元素,原子序数依次增大,
A的一种核素的原子核为质子,则A是H元素;
B原子的最外层电子数是次外层电子数的2倍,原子的最外层电子数不超过8个,所以其次外层为K层,则B原子的L层是最外层,L层电子数是4,所以B是C元素;
B原子的最外层电子数是D、E原子最外层电子数之和,D和E的原子序数大于B,所以D、E属于第三周期元素,D的原子序数小于E,所以D是Na元素、E是Al元素;
C的原子序数大于B而小于D,且C原子的最外层电子数是D、F原子最外层电子数之和,C是N或O或F或Ne元素,如果C是N元素,则F是Si元素,如果C是O元素,则F是P元素,如果C是F元素,则F是S元素,如果C是Ne元素,则F是Cl元素.
A.A是H元素、B是C元素,二者能形成烃中多种化合物,故A正确;
B.D的最高价氧化物的水化物是NaOH,E的最高价氧化物的水化物是Al(OH)3,NaOH和Al(OH)3反应生成偏铝酸钠,故B正确;
C.如果C是Ne元素,稀有气体元素Ne很难形成氢化物,故C错误;
D.如果C是O元素、F是P元素,二者能形成P2O5,故D正确;
故选C.
A的一种核素的原子核为质子,则A是H元素;
B原子的最外层电子数是次外层电子数的2倍,原子的最外层电子数不超过8个,所以其次外层为K层,则B原子的L层是最外层,L层电子数是4,所以B是C元素;
B原子的最外层电子数是D、E原子最外层电子数之和,D和E的原子序数大于B,所以D、E属于第三周期元素,D的原子序数小于E,所以D是Na元素、E是Al元素;
C的原子序数大于B而小于D,且C原子的最外层电子数是D、F原子最外层电子数之和,C是N或O或F或Ne元素,如果C是N元素,则F是Si元素,如果C是O元素,则F是P元素,如果C是F元素,则F是S元素,如果C是Ne元素,则F是Cl元素.
A.A是H元素、B是C元素,二者能形成烃中多种化合物,故A正确;
B.D的最高价氧化物的水化物是NaOH,E的最高价氧化物的水化物是Al(OH)3,NaOH和Al(OH)3反应生成偏铝酸钠,故B正确;
C.如果C是Ne元素,稀有气体元素Ne很难形成氢化物,故C错误;
D.如果C是O元素、F是P元素,二者能形成P2O5,故D正确;
故选C.
点评:本题考查了原子结构和元素周期律的关系,熟悉元素周期表结构及原子结构是解本题关键,根据元素周期表中原子之间的关系确定元素,再结合元素的性质分析解答,注意C有多种可能性多种F有多种可能性,考虑问题要缜密,题目难度中等.

练习册系列答案
相关题目
 中药狼把草全草浸剂给动物注射,有镇静、降压及轻度增大心跳振幅的作用.有机物M是中药狼把草的成分之一,其结构如图所示.下列叙述不正确的是( )
中药狼把草全草浸剂给动物注射,有镇静、降压及轻度增大心跳振幅的作用.有机物M是中药狼把草的成分之一,其结构如图所示.下列叙述不正确的是( )| A、M是芳香族化合物,它的分子式为C9H6O4 |
| B、1mol M最多能与3mol Br2发生反应 |
| C、1mol M最多能与含有3mol NaOH的溶液发生反应 |
| D、在一定条件下能发生取代、加成、水解、氧化等反应 |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、46g乙醇中含有的化学键数为7NA |
| B、1mol氯气和足量NaOH溶液反应转移电子数为2NA |
| C、1mol OH-和1mol-OH(羟基)中含有的质子数均为9NA |
| D、10L 0.1mol?L-1的Na2CO3溶液中,Na+、CO32-总数为3NA |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、NO3- | ||
B、常温下,
| ||
| C、滴入酚酞试液显红色的溶液:Mg2+、Al3+、Br-、SO42- | ||
| D、能溶解Al2O3的溶液:Na+、Ca2+、HCO3-、NO3- |
化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
| A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B、将“地沟油”制成肥皂,可以提高资源的利用率 |
| C、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
| D、减少烟花爆竹的燃放,有利于降低空气中的PM2.5含量 |
下列有关物质用途的叙述中不正确的是( )
| A、可用丁达尔现象区别溴水和Fe(OH)3胶体 |
| B、氧化铝可用作制造高温耐火材料,如制耐火砖、坩埚等 |
| C、加入适量NaOH溶液后过滤,以除去KCl溶液中少量的MgCl2 |
| D、FeCl3饱和溶液滴入NaOH溶液中可制备Fe(OH)3胶体 |
 用如图所示装置进行实验,实验现象正确的是( )
用如图所示装置进行实验,实验现象正确的是( )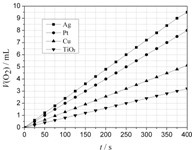 某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题:
某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题: