题目内容
11.下列有关反应离子方程式的书写中,正确的是( )| A. | 向浓氢氧化钠溶液中通入少量的CO2气体:CO2+OH-═HCO3- | |
| B. | 过量的NaHSO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 澄清石灰水中滴加少量的小苏打溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | 向Na2S2O3溶液中通入过量的氯气:S2O32-+2Cl-+3H2O═2SO32-+4Cl-+6H+ |
分析 A.通入少量的CO2气体,产物应是CO32-;
B.硫酸氢钠过量,离子方程式按照氢氧化钡的化学式组成书写;
C.碳酸氢钠少量,反应生成碳酸钙沉淀、氢氧化钠和水;
D.氯气过量,产物中不会生成SO32-.
解答 解:A.向浓氢氧化钠溶液中通入少量的CO2气体,反应生成碳酸根离子,正确的离子方程式为:CO2+2OH-═CO32-+H2O,故A错误;
B.过量的NaHSO4溶液能将OH-充分反应完,正确的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故B错误;
C.澄清石灰水中滴加少量的小苏打溶液,反应的离子方程式为:Ca2++OH-+HCO3-═CaCO3↓+H2O,故C正确;
D.向Na2S2O3溶液中通入过量的氯气,反应生成硫酸根离子,正确的离子方程式为:S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
2.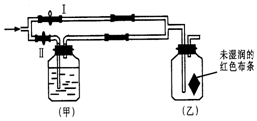 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,再通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,再通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
①浓H2SO4②饱和NaCl溶液 ③浓NaOH溶液 ④石灰水.
 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,再通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,再通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( ) ①浓H2SO4②饱和NaCl溶液 ③浓NaOH溶液 ④石灰水.
| A. | ① | B. | ②③④ | C. | ①③④ | D. | ③④ |
19.某原电池总反应离子方程式为2Fe3++Fe═3Fe2+,能实现该反应的原电池是( )
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液 | |
| C. | 正极为Fe,负极为Cu,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为Ag,负极为Zn,电解质溶液为CuSO4溶液 |
6.工业上以硫铁矿为原料制硫酸所产生的尾气中含有SO2,为便于监控,实施环境保护,下列适合测定硫酸尾气中SO2含量的试剂是( )
| A. | 品红溶液 | B. | 浓硝酸 | C. | 碘水、淀粉溶液 | D. | 以上都能 |
16.下列有关物质的性质说法正确的是( )
| A. | 碳酸氢钠比碳酸钠热稳定强 | |
| B. | Na2O2可用作供氧剂 | |
| C. | K2FeO4具有强还原性且被氧化生成Fe3+,可用于水的消毒和净水 | |
| D. | 打磨过的铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应 |
6.“粗盐提纯”的实验中,蒸发时,正确的操作是( )
| A. | 把浑浊的液体倒入蒸发皿中加热 | B. | 开始析出晶体后用玻璃棒搅拌 | ||
| C. | 待水分完全蒸干后停止加热 | D. | 蒸发皿中出现多量固体时停止加热 |
7.下列说法不正确的是( )
| A. | 乙烷与氯气在光照条件下发生加成反应 | |
| B. | 甲烷和乙烯都可以与氯气反应,反应类型不同 | |
| C. | 蔗糖、油脂、蛋白质都可以水解 | |
| D. | 乙醇能够被酸性的高锰酸钾溶液直接氧化成乙酸 |