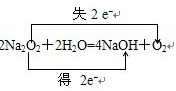
题目内容
在溶液中KClO3和NaHSO3反应速率开始时极慢,过一段时间后出现小气泡(SO2),随后气泡增多,后来气泡又减少,最后反应停止.这个反应的过程是:
HSO3-+ClO3-![]() HClO3+
HClO3+![]()
HClO3+4NaHSO3![]() 3NaHSO4+H2SO3+NaCl
3NaHSO4+H2SO3+NaCl
试回答下列问题:
(1)开始时为什么速率慢?
(2)为什么随后增快?
(3)为什么最后又变慢?
(4)上述反应中H+起什么作用?
(5)大体上画出v-t图像.
答案:
解析:
解析:
|
答案:(1)反应HSO3-+ClO3- (2)第二个反应生成NaHSO4与H2SO3,酸性比NaHSO3强;反过来,反应(1)的进行同时使溶液酸性增加,有SO2放出,使第二个反应得以快速进行; (3)反应进行到一定程度时,NaHSO3及KClO3的浓度明显下降,致使两个反应都减慢,直到终止; (4)从上可知:反应的快慢与生成的c(H+)的大小有关,H+起催化剂的作用; (5)上面的反应是一个非线性关系,其v-t关系如图所示.
精析:综合复分解反应条件,反应速率与反应物浓度的关系、酸的强弱等知识进行分析. |

练习册系列答案
相关题目