题目内容
氯气在生产生活中应用广泛.
(1)工业上可用MnSO4溶液吸收氯气,获得Mn2O3,Mn2O3广泛应用于电子工业、印染工业等领域.请写出该化学反应的化学方程式______.
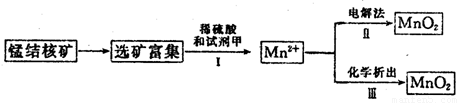
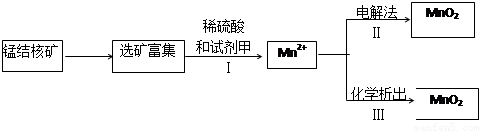
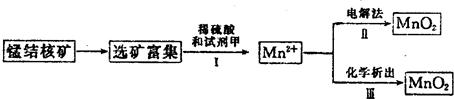
(2)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2.1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如图所示:
①步骤I中,试剂甲必须具有的性质是______(填序号).
a.氧化性b.还原性c.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol?L-1 的NaClO3溶液200mL,该反应的离子方程式为______.
解:(1)MnSO4溶液吸收氯气,获得Mn2O3,还生成硫酸和盐酸,该反应为2MnSO4+Cl2+3H2O═Mn2O3+2H2SO4+2HCl,
故答案为:2MnSO4+Cl2+3H2O═Mn2O3+2H2SO4+2HCl;
(2)①①步骤I中,Mn元素的化合价由+4价降低为+2价,则试剂甲应具有还原性,故答案为:b;
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol?L-1 的NaClO3溶液200mL,设还原产物中Cl的化合价为x,
则由电子守恒可知,0.05mol×(4-2)=0.1mol/L×0.2L×(5-x),解得x=0,即生成氯气,则离子反应为2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+,
故答案为:2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+.
分析:(1)MnSO4溶液吸收氯气,获得Mn2O3,还生成硫酸和盐酸,以此书写反应方程式;
(2)①步骤I中,Mn元素的化合价由+4价降低为+2价;
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol?L-1 的NaClO3溶液200mL,利用电子守恒确定还原产物,以此书写离子反应.
点评:本题以氯气及其化合物的性质考查氧化还原反应,明确信息及流流程中Mn元素的化合价变化、电子守恒即可解答,题目难度中等.
故答案为:2MnSO4+Cl2+3H2O═Mn2O3+2H2SO4+2HCl;
(2)①①步骤I中,Mn元素的化合价由+4价降低为+2价,则试剂甲应具有还原性,故答案为:b;
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol?L-1 的NaClO3溶液200mL,设还原产物中Cl的化合价为x,
则由电子守恒可知,0.05mol×(4-2)=0.1mol/L×0.2L×(5-x),解得x=0,即生成氯气,则离子反应为2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+,
故答案为:2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+.
分析:(1)MnSO4溶液吸收氯气,获得Mn2O3,还生成硫酸和盐酸,以此书写反应方程式;
(2)①步骤I中,Mn元素的化合价由+4价降低为+2价;
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol?L-1 的NaClO3溶液200mL,利用电子守恒确定还原产物,以此书写离子反应.
点评:本题以氯气及其化合物的性质考查氧化还原反应,明确信息及流流程中Mn元素的化合价变化、电子守恒即可解答,题目难度中等.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目


 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O