题目内容
Na2CO3?10H2O与NaHCO3混合物5.38g,测得含有Na+0.05mol.
(1)若将混合物加热至恒温,则固体混合物减轻多少克?
(2)若将5.38g混合物加入含HCl0.05mol的盐酸,可得标准状况下的CO2多少升?
(1)若将混合物加热至恒温,则固体混合物减轻多少克?
(2)若将5.38g混合物加入含HCl0.05mol的盐酸,可得标准状况下的CO2多少升?
考点:有关混合物反应的计算,钠的重要化合物
专题:计算题
分析:(1)加热Na2CO3?10H2O、NaHCO3的混合物至恒温,得到的固体为碳酸钠,根据钠离子守恒计算出碳酸钠的物质的量,再根据质量守恒计算出混合物减少的质量;
(2)含有0.05mol钠离子的Na2CO3?10H2O、NaHCO3的混合物中进入0.05mol盐酸,恰好反应生成氯化钠、二氧化碳和水,设出Na2CO3?10H2O、NaHCO3的物质的量,根据总质量、钠离子的物质的量列式计算,然后根据C原子守恒计算出生成二氧化碳的物质的量及标况下的体积.
(2)含有0.05mol钠离子的Na2CO3?10H2O、NaHCO3的混合物中进入0.05mol盐酸,恰好反应生成氯化钠、二氧化碳和水,设出Na2CO3?10H2O、NaHCO3的物质的量,根据总质量、钠离子的物质的量列式计算,然后根据C原子守恒计算出生成二氧化碳的物质的量及标况下的体积.
解答:
解:(1)将混合物加热至恒温,此时生成了碳酸钠,根据钠离子守恒可知最终得到碳酸钠的物质的量为:0.05mol×
=0.025mol,碳酸钠的质量为:106g/mol×0.025mol=2.65g,则固体混合物减少的质量为:5.38g-2.65g=2.73g,
答:固体混合物减轻2.73g;
(2)设Na2CO3?10H2O的物质的量为xmol、NaHCO3的物质的量为ymol,
根据二者质量可得:①286x+84y=5.38,
根据钠离子守恒可得:②2x+y=0.05mol,
①②联立解得:x=0.01mol、y=0.03mol,
加入0.05mol氯化氢时,固体混合物恰好与盐酸反应生成氯化钠、二氧化碳气体和水,
根据碳原子守恒,则放出二氧化碳的物质的量为:0.01mol+0.03mol=0.04mol,
标准状况下0.04mol二氧化碳的体积为:22.4L/mol×0.04mol=0.896L,
答:反应生成标准状况下的CO2体积为0.896L.
| 1 |
| 2 |
答:固体混合物减轻2.73g;
(2)设Na2CO3?10H2O的物质的量为xmol、NaHCO3的物质的量为ymol,
根据二者质量可得:①286x+84y=5.38,
根据钠离子守恒可得:②2x+y=0.05mol,
①②联立解得:x=0.01mol、y=0.03mol,
加入0.05mol氯化氢时,固体混合物恰好与盐酸反应生成氯化钠、二氧化碳气体和水,
根据碳原子守恒,则放出二氧化碳的物质的量为:0.01mol+0.03mol=0.04mol,
标准状况下0.04mol二氧化碳的体积为:22.4L/mol×0.04mol=0.896L,
答:反应生成标准状况下的CO2体积为0.896L.
点评:本题考查了混合物反应的计算,题目难度中等,注意掌握反应原理,明确质量守恒定律在化学计算中的应用,(2)需要判断过量情况、正确判断(1)的最终产物为解答关键.

练习册系列答案
相关题目
 向下列各组物质的混合溶液中滴加NaOH溶液,其现象与图象描述一致的是( )
向下列各组物质的混合溶液中滴加NaOH溶液,其现象与图象描述一致的是( )| A、HCl和Ba(NO3)2 |
| B、CuSO4和H2SO4 |
| C、CuSO4和Na2SO4 |
| D、Na2SO4和Ba(NO3)2 |
NA表示阿伏伽德罗常数.下列叙述正确的是( )
| A、1mol CH4所含原子总数是5NA |
| B、32g硫与足量铜完全反应转移的电子数为2NA |
| C、2L 1mol/L的盐酸溶液中,所含氯化氢分子个数是2NA |
| D、2mol SO2和1mol O2混合后,在V2O5存在的条件下密闭容器中加热反应后,容器内分子总数是2NA |
下列实验操作方法不正确的是( )
| A、试管内壁附着的硫黄可以用热的KOH溶液洗涤,也可以用CS2洗涤 |
| B、盛Na2SO3、Na2S、KI溶液的试剂瓶不能用玻璃塞,贮存时应盖好瓶塞,防止被空气氧化 |
| C、金属镁着火可用干粉灭火器灭火,也可用泡沫灭火器灭火 |
| D、从硫酸铜溶液中获取硫酸铜晶体,可以用蒸发结晶,也可以用冷却结晶 |
浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)═CaCl2+Cl2↑+2H2O.用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是( )
①CO2 ②HCl ③H2O(气) ④O2.
①CO2 ②HCl ③H2O(气) ④O2.
| A、①②③④ | B、②③④ |
| C、②③ | D、①④ |
下列各组物质久置于空气中,三种物质的质量都增加的一组是( )
| A、硅胶、生石灰、浓硫酸 |
| B、碱石灰、亚硫酸钠、浓盐酸 |
| C、碳酸钠晶体、无水硫酸铜、食盐 |
| D、苛性钠、无水乙醇、浓氨水 |
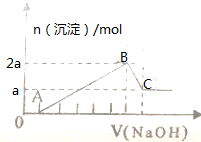 100mL某无色溶液由H+、Na+、Mg2+、Al3+、Fe3+、CO32-、Cl-等离子中的几种混合组成(不考虑水电离出的离子),向溶液中逐滴加0.5mol/L氢氧化钠溶液直到过量,产生沉淀的情况如图所示.
100mL某无色溶液由H+、Na+、Mg2+、Al3+、Fe3+、CO32-、Cl-等离子中的几种混合组成(不考虑水电离出的离子),向溶液中逐滴加0.5mol/L氢氧化钠溶液直到过量,产生沉淀的情况如图所示.