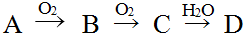题目内容
12.下列各组顺序的排列不正确的是( )| A. | 酸性:HClO4>HNO3>H2CO3 | B. | 离子半径:Na+<Mg2+<Al3+ | ||
| C. | 热稳定性:HCl>H2S>PH3>SiH4 | D. | 碱性强弱:KOH>NaOH>LiOH |
分析 A.非金属性越强,最高价氧化物对应的水化物酸性越强;
B.具有相同电子层排布的离子,质子数越多,半径越小;
C.元素非金属性越强,氢化物越稳定;
D.金属性越强,最高价氧化物对应的水化物碱性越强.
解答 解:A.因非金属性Cl>N>C,所以酸性HClO4>HNO3>H2CO3,故A正确;
B.具有相同电子层排布的离子,质子数越多,半径越小,因此离子半径:Na+>Mg2+>Al3+,故B错误;
C.因非金属性Cl>S>P>Si,所以热稳定性:HCl>H2S>PH3>SiH4,故C正确;
D.因金属性K>Na>Li,所以碱性:KOH>NaOH>LiOH,故D正确;
故选B.
点评 本题考查元素周期律的递变规律,题目难度不大,学习中注意把握元素周期律,注意总结金属性和非金属性强弱的判断依据.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
3.金属阳离子M2+的原子核外电子排布与氖原子相同,则M元素在元素周期表中的位置是( )
| A. | 第二周期第ⅡA族 | B. | 第三周期第ⅢA 族 | C. | 第三周期第ⅡA 族 | D. | 第二周期第ⅥA族 |
7.下列物质不存在顺反异构的是( )
| A. | CH3CH=CHCH3 | B. | CHCl=CHCl | C. | CH3CH=C(CH3)2 | D. | CH3CH2CH=CHBr |
4.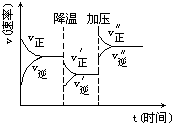 图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
 图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | A、B、C、D均为气体 | B. | 若A、B是气体,则C、D是液体或固体 | ||
| C. | 逆反应是放热反应 | D. | 在整个过程中,A的转化率一直增大 |
2.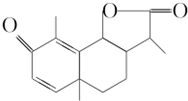 从菊科植物茼蒿的花中提取的一种有机化合物可用作驱肠虫剂,其结构简式如图所示.下列判断正确的是( )
从菊科植物茼蒿的花中提取的一种有机化合物可用作驱肠虫剂,其结构简式如图所示.下列判断正确的是( )
 从菊科植物茼蒿的花中提取的一种有机化合物可用作驱肠虫剂,其结构简式如图所示.下列判断正确的是( )
从菊科植物茼蒿的花中提取的一种有机化合物可用作驱肠虫剂,其结构简式如图所示.下列判断正确的是( )| A. | 该有机化合物的分子式为C14H15O3 | B. | 该有机化合物含有两种官能团 | ||
| C. | 该有机化合物是芳香烃的衍生物 | D. | 该有机化合物可看作环状化合物 |

 .
. 、
、 .
.