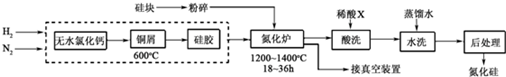
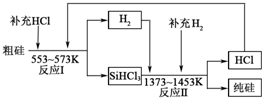
题目内容
1.在实验室里做钠跟水反应的实验时,用到的仪器是( )a.试管夹 b.镊子 c.小刀 d.冷凝管 e.滤纸 f.研钵 g.烧杯h.坩埚i.石棉网 j.玻璃片 k.药匙 l.燃烧匙.
| A. | abdi | B. | cefk | C. | fghl | D. | bcegj |
分析 根据各种仪器的作用选取仪器,注意取用块状固体药品时用镊子,据此分析.
解答 解:实验室里做钠跟水反应的实验时,取用块状固体药品时用镊子,将金属钠放在玻璃片上,用小刀切一小块钠,用滤纸擦干表面的煤油,用烧杯盛放水,用玻璃棒覆盖烧杯,防止钠飞出,所以用到的仪器是镊子、小刀、滤纸、烧杯、玻璃片,则是bcegj,故D正确.
故选D.
点评 本题考查仪器的选取,根据实验操作时需要的仪器解答,难度不大.

练习册系列答案
相关题目
11.将充有n mLNO和m mLNO2气体的试管倒立于盛水的水槽中,然后通入n mLO2.m>n,则充分反应后,试管中气体在同温同压下的体积为( )
| A. | $\frac{3}{(m-n)}$mL | B. | $\frac{(m-n)}{3}$ mL | C. | $\frac{(4m-1)}{13}$ mL | D. | $\frac{(m-n)}{3}$3 mL |
12.有机物X(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多,该化合物具有如下性质:
(1)1molX与足量的金属钠反应产生1.5mol气体
(2)X与醇或羧酸在浓H2SO4和加热的条件下均生成有香味的产物
(3)X在一定程度下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应根据上述信息
对X的结构判断正确的是( )
(1)1molX与足量的金属钠反应产生1.5mol气体
(2)X与醇或羧酸在浓H2SO4和加热的条件下均生成有香味的产物
(3)X在一定程度下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应根据上述信息
对X的结构判断正确的是( )
| A. | X中可能有两个羧基和一个羟基 | |
| B. | X中可能有三个羟基和一个 一COOR官能团 | |
| C. | X中肯定有碳碳双键 | |
| D. | X中可能有三个羧基 |
9.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 在0.1molNaHSO4晶体中阳离子与阴离子总数为0.3NA | |
| B. | 1.0L0.1mol•L-1NH4NO3溶液中含有的铵根离子数是0.1×6.02×1023 | |
| C. | 7.8gNa2O2与足量CO2反应,转移的电子数为0.1NA | |
| D. | 向仅含0.2molFeI2的溶液中持续通入氯气,当有0.1molFe2+被氧化时,需通入标况下C121.12L |
16.已知室温下,某溶液中由水电离出的H+和OH-的物质的量浓度的乘积约为1×10-24,则在该溶液中,一定能大量存在的离子是( )
| A. | NH4+ | B. | NO3- | C. | AlO2- | D. | HCO3- |
13.Ⅰ:工业制硫酸时,利用接触氧化反应将SO 2转化为SO3是一个关键步骤.
(1)某温度下,2SO2(g)+O 2(g)?2SO3(g)△H=-197kJ/mol.开始时在10L的密闭容器中加入8.0mol SO2(g)和20.0mol O 2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K=0.56(保留两位有效数字),若升高温度时,K将减小(填“增大、减小或不变”).
(2)若体积不变的条件下,下列措施中有利于提高SO2的转化率条件是AC(填字母).
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(3)在硫酸工业生产过程中,有反应2SO2(g)+O2(g)?2SO3(g)(正反应为放热反应),根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件(以V2O5作催化剂)温度450℃;压强1×105Pa.
(4)能判断该反应达到平衡状态的依据是ACF.
A.容器的压强不变 B.混合气体的密度不变
C.混合气体中SO 3的浓度不变 D.C(SO 2)=C(SO 3)
E.v 正(SO 2)=v 正(SO 3) F.v 正(SO 3)=2v 逆(O 2)
Ⅱ:研究化学反应原理对于生产生活是很有意义的.
(1)在0.10mol•L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=2.2×10-8mol•L-1(Ksp[Cu(OH)2]=2.2×10-20).
(2)若在0.1mol•L-1硫酸铜溶液中通入H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是0.2mol•L-1.
(1)某温度下,2SO2(g)+O 2(g)?2SO3(g)△H=-197kJ/mol.开始时在10L的密闭容器中加入8.0mol SO2(g)和20.0mol O 2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K=0.56(保留两位有效数字),若升高温度时,K将减小(填“增大、减小或不变”).
(2)若体积不变的条件下,下列措施中有利于提高SO2的转化率条件是AC(填字母).
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(3)在硫酸工业生产过程中,有反应2SO2(g)+O2(g)?2SO3(g)(正反应为放热反应),根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件(以V2O5作催化剂)温度450℃;压强1×105Pa.
| 1×105Pa | 5×105Pa | 10×105Pa | 50×105Pa | 100×105Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
A.容器的压强不变 B.混合气体的密度不变
C.混合气体中SO 3的浓度不变 D.C(SO 2)=C(SO 3)
E.v 正(SO 2)=v 正(SO 3) F.v 正(SO 3)=2v 逆(O 2)
Ⅱ:研究化学反应原理对于生产生活是很有意义的.
(1)在0.10mol•L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=2.2×10-8mol•L-1(Ksp[Cu(OH)2]=2.2×10-20).
(2)若在0.1mol•L-1硫酸铜溶液中通入H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是0.2mol•L-1.
10.下图所示的实验操作中,正确的是( )
| A. |  取用药品 | B. |  给试管加热 | ||
| C. |  滴加液体 | D. |  称量10.05g固体 |
11.下列离子方程式书写正确的是( )
| A. | 碳酸钙与盐酸反应 CO32-+2H+═CO2↑+H2O | |
| B. | 往CuCl2溶液中加入钠 2Na+Cu2+═2Na++Cu | |
| C. | 铁与稀硫酸反应 Fe+2H+═Fe2++H2↑ | |
| D. | 稀硫酸与氢氧化钡溶液反应 H++SO42-+Ba2++OH-═H2O+BaSO4↓ |