题目内容
常温常压下,将30 mL NO和10 mL O2混合,所得气体的平均相对分子质量…( )A.等于30.5 B.等于40.7 C.介于30.5和40.7之间 D.大于40.7
D
错解:根根NO和O2反应的方程式:2NO+O2====2NO2,得10 mL O2和20 mL NO化合生成20 mL NO2,NO过量10 mL。则NO2和NO的平均相对分子质量为:(46×20 mL+30×10 mL)/30 mL≈40.7。选B项。
正解:常温常压下,不仅NO和O2能化合生成NO2,生成的NO2还有部分化合为N2O4,2NO2![]() N2O4。故所得气体平均相对分子质量大于40.7,答案为D项。
N2O4。故所得气体平均相对分子质量大于40.7,答案为D项。

 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) DH1
CO(g)+3H2(g) DH1
②CO(g)+2H2(g)![]() CH3OH(g) DH2
CH3OH(g) DH2
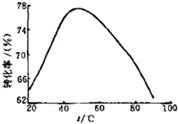
将0.20 mol CH4和0.30 mol H2O(g)通入容积为10 L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。
⑴温度不变,缩小体积,①的逆反应速率 (填“增大”、“减小”或“不变”)。
⑵反应①的DH1 0(填“<”“=”或“>”)100°C时的平衡常数值K= 。
⑶在压强为0.1Mpa条件下,将amolCO与3amolH2的混合气体在催化剂作用下进行反应②再生成甲醇。为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中。请在空格中填入剩余的实验条件数据。
| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | 5 | ||
| III | 350 | 5 |
300°C时,其他条件不变,将容器的容积压缩到原来的1/2,对平衡体系产生的影响是(填字母)( )
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时c(H2)/c(CH2OH)减小
⑷已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)DH=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) DH=-556.0 kJ·mol-1
③H2O(g)=H2O(l)DH=-44.0 kJ·mol-1
 写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式 。
写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式 。
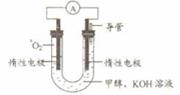
⑸某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。

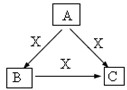 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图.请针对以下三种不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图.请针对以下三种不同情况回答: