题目内容
17.m g铜、铁的混合物与一定量浓硝酸完全反应后,向所得到的溶液中滴加KSCN,溶液变为血红色,将所得气体与3.36L O2(标准状况)混合后通入水中,所有气体能完全被水吸收生成硝酸.若向所得溶液中加入NaOH溶液至恰好完全沉淀,则生成沉淀的质量为( )| A. | (m+4.8)g | B. | (m+5.1)g | C. | (m+10.2)g | D. | (m+19.2)g |
分析 m g铜、铁的混合物与一定量浓硝酸完全反应后,向所得到的溶液中滴加KSCN,溶液变为血红色,说明Fe被氧化生成铁离子,将所得气体与3.36L O2(标准状况)混合后通入水中,所有气体能完全被水吸收生成硝酸,则N元素失去电子数等于氧气得到电子数,也等于金属失去电子数,则金属失去电子物质的量=$\frac{3.36L}{22.4L/mol}×4$=0.6mol,金属阳离子和氢氧根离子结合生成氢氧化物沉淀,氢氧根离子物质的量等于金属失去电子物质的量=0.6mol,生成沉淀的质量等于合金质量与氢氧根离子质量之和.
解答 解:m g铜、铁的混合物与一定量浓硝酸完全反应后,向所得到的溶液中滴加KSCN,溶液变为血红色,说明Fe被氧化生成铁离子,将所得气体与3.36L O2(标准状况)混合后通入水中,所有气体能完全被水吸收生成硝酸,则N元素失去电子数等于氧气得到电子数,也等于金属失去电子数,则金属失去电子物质的量=$\frac{3.36L}{22.4L/mol}×4$=0.6mol,金属阳离子和氢氧根离子结合生成氢氧化物沉淀,氢氧根离子物质的量等于金属失去电子物质的量=0.6mol,生成沉淀的质量等于合金质量与氢氧根离子质量之和,则沉淀质量=mg+0.6mol×17g/mol=(m+10.2)g,故选C.
点评 本题考查氧化还原反应有关计算,侧重考查学生分析计算能力,明确金属转移电子与金属生成碱需要氢氧根离子物质的量关系是解本题关键,注意转移电子守恒的灵活运用,题目难度中等.

练习册系列答案
相关题目
7.在下列物质中,所含化学键类型相同的一组是( )
| A. | CCl4、CH4 | B. | NH4Cl、HCl | C. | NaOH、H2O | D. | Na2S、SO2 |
8.下列事实与胶体性质无关的是( )
| A. | 向豆浆中加入盐卤做豆腐 | |
| B. | 一束平行光线射入蛋白质溶液中,从侧面可以看到一束光亮的通路 | |
| C. | 黄河入海口形成了三角洲 | |
| D. | 将二氧化碳通入澄清石灰水中,一段时间后,石灰水变浑浊 |
12.某一元强酸稀溶液和某一元弱碱稀溶液等体积混合后,溶液pH等于7.0,则以下叙述正确的是( )
| A. | 酸溶液的物质的量浓度大于碱溶液的物质的量浓度 | |
| B. | 酸溶液中H+的浓度小于碱溶液中0H-的浓度 | |
| C. | 酸和碱混合时,碱过量 | |
| D. | 酸溶液的pH与碱溶液pH之和为14 |
6.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 常温常压下,16gS03中含有的分子数为0.2NA | |
| B. | 常温下,30gSiO2晶体中含有Si--O键的数目为NA | |
| C. | 标准状况下,2.2 LCl2与足量水反应转移的电子数为0.1NA | |
| D. | 标准状况下,92.4 LNO与11.2LO2混合后所含分子数为NA |


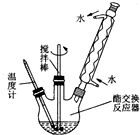 为了综合利用地沟油,我国将地沟油提炼成生物柴油可替换柴油做燃料,目前技术已经非常成熟.生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过酯交换生成新酯和新醇得到.已知油脂与甲醇互不相溶,反应中若有游离脂肪酸和水,将妨碍酯的交换.酯交换反应为:R1COOR2+R3OH→R1COOR3+R2OH.地沟油的预处理过程如下:
为了综合利用地沟油,我国将地沟油提炼成生物柴油可替换柴油做燃料,目前技术已经非常成熟.生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过酯交换生成新酯和新醇得到.已知油脂与甲醇互不相溶,反应中若有游离脂肪酸和水,将妨碍酯的交换.酯交换反应为:R1COOR2+R3OH→R1COOR3+R2OH.地沟油的预处理过程如下: