题目内容
已知A是一种常见的单质气体,X是一种淡黄色的固体,Y是一种常见的液体,Z是一种有刺激性气味、极易溶于水的气体。有关的转化关系如下(反应条件均已略去):
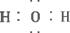
回答下列问题:
(1)写出X的化学式_________;Y的电子式_________。
(2)Z与N反应生成化合物的水溶液呈_________(选填“酸性“中性”“碱性”)。
(3)请写出C的稀溶液与N的稀溶液反应的热化学方程式(已知中和热为57.3 kJ·mol-1)
___________________________________________________。
(1)Na2O2 ![]()
(2)酸性
(3)HNO3(aq)+NaOH(aq)====NaNO3(aq)+H2O(1);△H=-57.3 kJ·mol-1

 名校课堂系列答案
名校课堂系列答案(13分)A、B、C、D、E是元素周期表中前四周期常见元素,其原子序数依次增大。已知:
|
A |
单质在自然界中硬度最大 |
|
B |
原子中s能级与p能级电子数相等且有单电子 |
|
C |
C同在B的下一周期,C的电离能数据(kJ ·mol-1)为:I1=738 I2=1451 I3=7732 I4=10540 |
|
D |
单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物 |
|
E |
单质是一种常见金属,与O元素能形成黑色和砖红色两种氧化物 |
(1)写出A元素基态原子的价电子排布图 。当C单质、D单质和NaOH溶液形成原电池时,该原电池的负极的电极反应式为:
(2)常温下,某气态单质甲分子与AB分子核外电子数相等,则一个甲分子中包含 个π键,在A—H、B—H两种共价键中,键的极性较强的是 (用元素符号表示)。D元素原子核内中子数比质子数多1,则D原子可以表示为 ,其原子核外有 种运动状态不同的电子。
(3)B的氢化物的熔沸点比与它同主族的下一周期元素的氢化物的熔沸点高,原因是
。
(4)通常情况下,A的燃烧热为a kJ ·mol-1,C的燃烧热为b kJ ·mol-1,则C与AO2反应生成A的热化学方程式为 。
 ,已知断裂1molB-B吸收167kJ的热量,生成1molB≡B放出942kJ热量.试写出由B4气态分子变成B2气态分子的热化学方程式:
,已知断裂1molB-B吸收167kJ的热量,生成1molB≡B放出942kJ热量.试写出由B4气态分子变成B2气态分子的热化学方程式:

