题目内容
现有2mol/L的盐酸和硫酸溶液各100mL,分别加入等质量的Fe,反应后所生成的气体在相同状况时体积比为2∶3,求加入盐酸中Fe的质量.
解析:
|
提示:加入到盐酸、硫酸中的Fe的质量相等,但产生 100mL2mol/L的盐酸含HCl0.2mol,完全与Fe反应,产生 据已知条件,Fe与硫酸反应产生的 所以加入到盐酸中的Fe也为8.4g. |

 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案(18分)、现有下列物质:①H2S、②NH3、③H2SO4、④NaHCO3、
⑤CH3COOH、⑥KNO3溶液、⑦盐酸、⑧酒精、⑨二元酸H2A等。请回答下列问题(请填入序号)。
(1)其中一定属于弱电解质的是 。不能确定的是 ,请设计一个实验以证明它是强电解质还是弱电解质。你的实验和结论是
;
(2)H2S在水中的电离方程式为 __________;
NaHCO3在水中的电离方程式为 ; 已知H2A的电离方程式为:H2A ="=" H++HA-; HA- H++A2-。试判断H2A是 电解质(填“强”或“弱”)。
已知H2A的电离方程式为:H2A ="=" H++HA-; HA- H++A2-。试判断H2A是 电解质(填“强”或“弱”)。
(3)2mol/L的盐酸和2mol/L的醋酸各100ml,分别与过量的Zn反应,生成H2的体积,V(盐酸) V(醋酸)(填>、=或<);氢离子浓度相等的盐酸和醋酸各100ml,分别与过量的Zn反应,生成H2的体积V(盐酸) V(醋酸) (填>、=或<);理由是
; (4)已知CH3COO-+H+ CH3COOH;现要使平衡向右移动且氢离子浓度增大,应采取的措施是( )
(4)已知CH3COO-+H+ CH3COOH;现要使平衡向右移动且氢离子浓度增大,应采取的措施是( )
| A.加NaOH | B.加盐酸 | C.加水 | D.升高温度 |
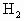 的量不等,同状况下
的量不等,同状况下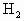 的体积比为2∶3.由此可推知:Fe与盐酸作用时Fe过量,Fe与硫酸作用时硫酸过量.
的体积比为2∶3.由此可推知:Fe与盐酸作用时Fe过量,Fe与硫酸作用时硫酸过量.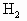 0.1mol
0.1mol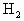 为0.1×
为0.1×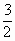 =0.15(mol),用去的Fe也为0.15mol56×0.15=8.4(g)
=0.15(mol),用去的Fe也为0.15mol56×0.15=8.4(g) 已知H2A的电离方程式为:H2A == H++HA-; HA-
H++A2-。试判断H2A是 电解质(填“强”或“弱”)。
已知H2A的电离方程式为:H2A == H++HA-; HA-
H++A2-。试判断H2A是 电解质(填“强”或“弱”)。 已知H2A的电离方程式为:H2A == H++HA-; HA- H++A2-。试判断H2A是 电解质(填“强”或“弱”)。
已知H2A的电离方程式为:H2A == H++HA-; HA- H++A2-。试判断H2A是 电解质(填“强”或“弱”)。