题目内容
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5 kJ/mol;
2C(s)+O2(g)=2CO(g) △H2=-221.0 kJ/mol;
C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/mol
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=___________。
(2)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①该温度下,若向同容积的另一容器中投入N2、H2、NH3,其浓度均为3 mol/L,则此时v正____v逆(填“大于”“小于”或“等于”)。
②由表中的实验数据可得到“c—t”的关系,如图1所示,表示c(N2)—t的曲线是______。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为________。
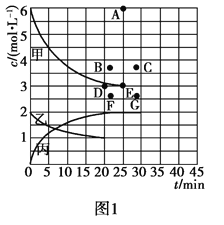
![]() N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图2所示:
N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图2所示:
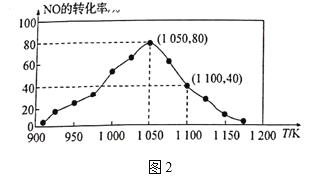
①由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为_______;在1100K时,CO2的体积分数为__________。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=______[已知:气体分压(P分)=气体总压(Pa)×体积分数]。
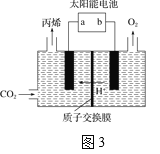
(4)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理如图3所示
①太阳能电池的负极是_______(填“a”或“b”)
②生成丙烯的电极反应式是___________。
【答案】-746.5 kJ /mol 大于 乙 B 1050K前反应未达到平衡状态,随着温度升高,反应速率加快,NO转化率增大 20% 4 a 3CO2+18H++18e-=C3H6+6H2O
【解析】
(1)根据盖斯定律进行分析;
(2)①该温度下,25 min时反应处于平衡状态,平衡时c(N2)=1 mol/L、c(H2)=3 mol/L、c(NH3)=2 mol/L,带入平衡常数表达式计算;在该温度下,若向同容积的另一容器中投入N2、H2和NH3,其浓度均为3mol/L,计算出浓度商Qc,将计算结果与平衡常数K比较判断分析进行方向;
②N2的初始浓度为2mol/L,且浓度逐渐减小,据此判断;起始充入4 mol N2和12 mol H2,相当于将充入2.00 mol N2和6.00 mol H2的两个容器“压缩”为一个容器,假设平衡不移动,则平衡时c(H2)=6 mol/L,而“压缩”后压强增大,反应速率加快,平衡正向移动,据此可知平衡时3 mol/L<c(H2)<6 mol/L,且达到平衡的时间缩短;
(3)①结合外界条件对反应速率、平衡状态的影响以及三段式计算得到;
②根据三段式计算Kp;
(4)①燃料电池中负极通燃料,正极通氧气;
②太阳能电池为电源,电解强酸性的二氧化碳水溶液得到丙烯,丙烯在阴极生成。
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol;
②2C(s)+O2(g)=2CO(g) △H=-221.0kJ/mol;
③C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol,根据盖斯定律③×2-②-①可得:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=-746.5kJ/mol;
(2)①该温度下,25 min时反应处于平衡状态,平衡时c(N2)=1 mol/L、c(H2)=3 mol/L、c(NH3)=2 mol/L,则K=![]() =
=![]() ;在该温度下,若向同容积的另一容器中投入N2、H2和NH3,其浓度均为3 molL-1,则Qc=
;在该温度下,若向同容积的另一容器中投入N2、H2和NH3,其浓度均为3 molL-1,则Qc=![]() =
=![]() <K,反应正向进行,故v正大于v逆;
<K,反应正向进行,故v正大于v逆;
②N2的初始浓度为2mol/L,且浓度逐渐减小,图象中曲线乙符合;起始充入4 mol N2和12 mol H2,相当于将充入2.00 mol N2和6.00 mol H2的两个容器“压缩”为一个容器,假设平衡不移动,则平衡时c(H2)=6 mol/L,而“压缩”后压强增大,反应速率加快,平衡正向移动,故平衡时3 mol/L<c(H2)<6 mol/L,且达到平衡的时间缩短,故对应的点为B;
(3)①1050 kPa 前,反应b中NO2转化率随着温度升高而增大的原因是,在1050kPa前反应未达平衡状态,随着温度升高,反应速率加快,物质的转化率增大;在1100kPa时NO转化率40%,结合三段式计算列式得到;
C(![]() N2(g)+CO2(g)
N2(g)+CO2(g)
起始量(mol) 2 0 0
变化量(mol) 2×0.4=0.8 0.4 0.4
平衡量(mol) 1.2 0.4 0.4
CO2的体积分数=![]() ×100%=20%;
×100%=20%;
②在1050K、1.1×106Pa时,NO的转化率为80%,则
C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
起始量(mol) 2 0 0
变化量(mol) 2×80%=1.6 0.8 0.8
平衡量(mol) 0.4 0.8 0.8
可知平衡时p(NO)=0.2P总,p(N2)=0.4p总,p(CO2)=0.4p总,Kp= =4;
=4;
(4)①在燃料电池中,负极通燃料,正极通氧气,故a是负极,b为正极;
②电解时,二氧化碳在b极上生成丙烯,得到电子的一极为电源的正极,则生成丙烯的电极反应式为:3CO2+18H++18e-=C3H6+6H2O。

 阅读快车系列答案
阅读快车系列答案