题目内容
8.将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3:2,则样品中铁、铝物质的量之比为( )| A. | 3:2 | B. | 3:4 | C. | 2:1 | D. | 4:3 |
分析 铁、铝与稀硫酸反应生成氢气,而铝与氢氧化钠反应生成氢气,铁不与氢氧化钠反应,两过程中Al生成的氢气相等,故两过程中体积之差为铁与硫酸反应生成的氢气,同温同压下气体体积之比等于其物质的量之比,再根据电子转移守恒计算Fe、Al之比物质的量之比.
解答 解:铁、铝与稀硫酸反应生成氢气,而铝与氢氧化钠反应生成氢气,铁不与氢氧化钠反应,两过程中Al生成的氢气相等,故两过程中体积之差为铁与硫酸反应生成的氢气,故Fe、Al与硫酸反应时生成的氢气体积之比为(3-2):2=1:2,同温同压下气体体积之比等于其物质的量之比,根据电子转移守恒,Fe、Al之比物质的量之比为$\frac{1}{2}$:$\frac{2}{3}$=3:4,
故选:B.
点评 本题考查混合物的有关计算,难度中等,关键是清楚发生的反应,注意根据电子转移守恒进行解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使苯酚显紫色的溶液:NH4+、K+、SCN-、NO3- | |
| B. | 加入铝粉产生氢气的溶液:Na+、K+、NO3-、Cl- | |
| C. | 澄清透明的溶液中:SO42-、K+、Cu2+、Cl- | |
| D. | 由水电离出的c(H+)•c(OH-)=10-22的溶液:Fe2+、Na+、NO3-、SO42- |
13.已知镁和稀硝酸反应时,每有1mol HNO3反应,就有0.8mol电子转移,此时硝酸的还原产物可能是( )
| A. | N2O | B. | NO2 | C. | N2O4 | D. | NO |
20.下列离子方程式正确的是( )
| A. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 浓硝酸溶液中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O | |
| C. | 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
18.下列离子方程式正确的是( )
| A. | CH3COOH在水中电离:CH3COOH═H++CH3COO- | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+H+═HCO3ˉ | |
| C. | 大理石中加入稀盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | MgC12溶液与过量氨水反应:Mg2++2OH-═Mg(OH)2↓ |

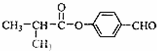 ;
;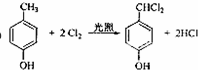 ;
;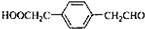 .
.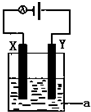 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1 ,B
,B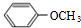 ,C
,C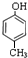 .
.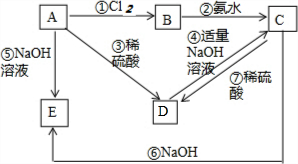 已知金属A为常见的金属单质,根据下列物质的转化关系完成各小题(图中表示主要物质的转化关系,反应中生成的水、气体等物质未标出)
已知金属A为常见的金属单质,根据下列物质的转化关系完成各小题(图中表示主要物质的转化关系,反应中生成的水、气体等物质未标出)