题目内容
某学生用托盘天平称量食盐时,他将食盐放在右盘,砝码放在左盘,称得食盐的质量为15.5g(1g以下使用游码添加质量).该学生所称量的食盐的实际质量为( )
| A、14.5g |
| B、15.5g |
| C、16.0g |
| D、15.0g |
考点:计量仪器及使用方法
专题:化学实验常用仪器
分析:天平的使用方法是左物右码,左盘的质量=右盘的质量+游码的质量,即:药品质量=砝码质量+游码质量,如果位置放反,则左盘的质量=右盘的质量+游码的质量,列等式进行计算即可.
解答:
解:由左盘的质量=右盘的质量+游码的质量可知:砝码质量=药品质量+游码的质量,
如果砝码和物体放反了,则:药品质量+游码读数=砝码质量,
药品质量=砝码质量-游码质量,
游码的读数为0.5g,砝码质量为15g,
则:药品的质量=15.0g-0.5g=14.5g,所以A正确,
故选A.
如果砝码和物体放反了,则:药品质量+游码读数=砝码质量,
药品质量=砝码质量-游码质量,
游码的读数为0.5g,砝码质量为15g,
则:药品的质量=15.0g-0.5g=14.5g,所以A正确,
故选A.
点评:本题考查了托盘天平的使用方法,题目难度不大,注意明确天平称量物质质量时要左物右码,如果砝码与药品放颠倒,则砝码质量=药品质量+游码读数.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
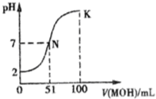 常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中不正确的是( )
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中不正确的是( )| A、HA为一元强酸 | ||
| B、N点水的电离程度小于K点水的电离程度 | ||
C、随着MOH溶液的滴加,比值
| ||
| D、若K点对应的溶液的PH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L |
下列物质中属于电解质的是( )
| A、盐酸 | B、蔗糖 | C、铜 | D、NaCl |
下列事实中不能应用勒夏特列原理来解释的是( )
| A、新制的氯水在光照条件下颜色变浅 |
| B、加入催化剂能使合成氨的速率加快 |
| C、高压对合成氨有利 |
| D、室温比500℃左右更有利于合成氨的反应 |
装满新制氯水的烧瓶倒置于水槽中经光照后,发现烧瓶底部有气体产生.该气体主要是( )
| A、Cl2 |
| B、O2 |
| C、HCl |
| D、H2 |
①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+K2SO4+7H2O
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4
下列结论正确的是( )
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+K2SO4+7H2O
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4
下列结论正确的是( )
| A、①②③均是氧化还原反应 |
| B、氧化性强弱顺序是K2Cr2O7>Fe2(SO4)3>I2 |
| C、反应②中氧化剂与还原剂的物质的量之比为6:1 |
| D、反应③中0.1mol还原剂共失去电子数为6.02×1023 |
类比是化学学习中一种常见的思维方式,以下使用类比的方法得出的结论正确的是( )
| A、CO2可以与Ca(ClO)2反应生成CaCO3和HClO,类比出SO2也可以与Ca(ClO)2反应生成CaSO3和HClO |
| B、实验室使用浓硫酸与NaCl固体共热的方法制取HCl,类比出也可以采用浓硫酸与KNO3固体共热的方法制取HNO3 |
| C、由CaCO3溶解度小于Ca(OH)2,类比出MgCO3溶解度小于Mg(OH)2 |
| D、碱金属单质的熔沸点从上到下依次降低,类比出卤素单质的熔沸点也是从上到下依次降低 |
 电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如下图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )
电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如下图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )| A、A膜是阳离子交换膜 |
| B、通电后,海水中阴离子往b电极处运动 |
| C、通电后,b电极上产生无色气体,溶液中出现白色沉淀 |
| D、通电后,a电极的电极反应式为4OH--4e-═O2↑+2H2O |