题目内容
电解某盐溶液时在阴阳两极上一定相等的是( )
| A、析出金属的物质的量 |
| B、通过的电子数目 |
| C、析出金属的质量 |
| D、放出气体的体积 |
考点:电解原理
专题:电化学专题
分析:根据电解池中阴阳两极上的得失电子守恒来分析.
解答:
解:A、C、电解某盐溶液时在阴阳两极上不会同时析出金属的,故A、C都错误;
B、根据电解池中阴阳两极上的得失电子守恒,确定通过的电子数目必定相等,故B正确;
D、根据电解池中阴阳两极上的得失电子守恒,当电解水型时放出的氢气和氧气就不等,故D错误;
故选:B.
B、根据电解池中阴阳两极上的得失电子守恒,确定通过的电子数目必定相等,故B正确;
D、根据电解池中阴阳两极上的得失电子守恒,当电解水型时放出的氢气和氧气就不等,故D错误;
故选:B.
点评:主要考查根据电解池中阴阳两极上的得失电子守恒来判断和有关计算.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的数值,下列叙述正确的是(相对原子量:H-1 C-12)( )
| A、1 mol/L氯化铜溶液中的Cu2+数小于NA |
| B、标准状况下,22.4 L Cl2参加任何化学反应转移的电子数都是2NA |
| C、常温常压下,16g氧气和16g臭氧(O3)所含有的氧原子数均为NA |
| D、1 mol CH5+所含电子数为8NA |
某化学反应2X(g)?Y(g)+Z(g)在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度(mol?L-1)随反应时间(min)的变化情况如下表:
下列说法不正确的是( )
| 实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| A、C>1.0 |
| B、实验2可能使用了催化剂 |
| C、实验3比实验2先达到化学平衡状态 |
| D、前10分钟,实验4的平均化学反应速率比实验1的大 |
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )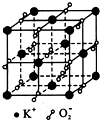

| A、超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2- |
| B、晶体中每个K+周围有8个O2-,每个O2-周围有8个K+ |
| C、晶体中与每个K+距离最近的K+有8个 |
| D、晶体中,0价氧原子与-2价氧原子的数目比为1:1 |
某气态烃1mol能和2mol Br2加成,其饱和产物又能和6mol Cl2完全取代,则该烃是( )
| A、C2H6 |
| B、C4H6 |
| C、C3H4 |
| D、C2H2 |
 电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是
电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是 电解CH3CHO是有毒物质,易溶于水,含高浓度CH3CHO的废水可以用隔膜电解法处理,总反应为:
电解CH3CHO是有毒物质,易溶于水,含高浓度CH3CHO的废水可以用隔膜电解法处理,总反应为: