题目内容
在100mL含等物质的量HBr和H2SO3的溶液里滴入氯水100mL(该氯水的浓度为0.1mol·L-1),有一半Br-变为Br2(已知Br2能氧化H2SO3),原溶液中HBr和H2SO3的浓度都等于________.
答案:
解析:
解析:
|
0.08mol·L-1 导解:此题首先要明确H2SO3的还原性比HBr强,Cl2首先氧化H2SO3,再氧化HBr.设原溶液中HBr和H2SO3的浓度都为x mol·L-1,则0.1L·x· |

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
在100mL含等物质的量HBr和H2SO3的溶液中通入0.01molCl2,有三分之二Br-变为Br2(已知Br2能氧化H2SO3),原溶液中HBr和H2SO3物质的量浓度为( )
| A、0.0075mol?L-1 | B、0.075mol?L-1 | C、0.4 mol?L-1 | D、0.08mol?L-1 |
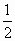 +0.1L·x·2=0.01mol·2,x=0.08mol·L-1.
+0.1L·x·2=0.01mol·2,x=0.08mol·L-1.