题目内容
【题目】下列实验方案、现象、得出的结论均正确的是( )
选项 | 实验及现象 | 结论 |
A | 用酸度计测定 |
|
B | 向待测液中依次滴入氯水和 | 待测溶液中含有 |
C | 向酸化的 | 证明 |
D | 其他条件相同,测定等浓度的 | td style="width:153.75pt; border-top-style:solid; border-top-width:0.75pt; border-left-style:solid; border-left-width:0.75pt; padding:3.38pt 5.62pt; vertical-align:middle">
A.AB.BC.CD.D
【答案】D
【解析】
A.饱和溶液的浓度不同,不能比较酸性,应测定等浓度时pH进行比较,故A错误;
B.先加氯水可氧化亚铁离子,不能排除铁离子的干扰,应先加KSCN溶液无现象,后加氯水检验亚铁离子,故B错误;
C.通常用硫酸酸化KMnO4溶液,原溶液中含有的硫酸根离子干扰了检验,无法证明SO2被氧化为SO42,故C错误;
D.测定等浓度的HCOOK和K2S溶液的pH,可比较甲酸与HS的酸性,即可比较![]() 和
和![]() 的大小,故D正确;
的大小,故D正确;
故答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )
A.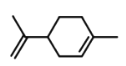 和
和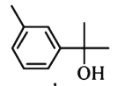 都属于芳香族化合物
都属于芳香族化合物
B. 和
和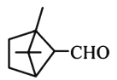 分子中所有碳原子均处于同一平面上
分子中所有碳原子均处于同一平面上
C. 、
、 和
和 均能使酸性
均能使酸性![]() 溶液褪色
溶液褪色
D. 和
和 均能与新制的
均能与新制的![]() 反应生成红色沉淀
反应生成红色沉淀
【题目】现有七种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等 |
B元素原子的核外p电子数比s电子数少1 |
C元素的第一至第四电离能如下: I1=738kJ·mol-1 I2=1451kJ·mol-1 I3=7733kJ·mol-1 I4=10540kJ·mol-1 |
D是前四周期中电负性最小的元素 |
E在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式:___。
(2)B元素基态原子中能量最高的电子的电子云在空间有___个伸展方向,原子轨道呈___形。
(3)某同学根据上述信息,推断C基态原子的电子排布图为![]() ,该同学所画的电子排布图违背了___。
,该同学所画的电子排布图违背了___。
(4)E位于第__族、__区,该元素原子的核外电子排布式为___。
(5)检验D元素的方法是___,请用原子结构的知识解释产生此现象的原因:__。