题目内容
16.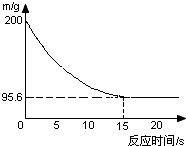 化学实验室有一瓶Na2CO3和NaCl固体混合物粉末,现小张同学取该固体粉末14.9g于烧杯中,并向烧杯中加入149.5g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如图所示:烧杯连同药品的起始质量为200g.
化学实验室有一瓶Na2CO3和NaCl固体混合物粉末,现小张同学取该固体粉末14.9g于烧杯中,并向烧杯中加入149.5g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如图所示:烧杯连同药品的起始质量为200g.回答下列问题:
(1)当固体混合物与稀盐酸恰好完全反应时,所需时间约为15s.
(2)完全反应后,产生二氧化碳气体质量4.4g.
(3)反应后,得到室温下的不饱和溶液.所得溶液中溶质的质量分数为多少?
分析 (1)欲知当固体混合物与稀盐酸恰好完全反应时,所需时间,必须认识到,恰好反应后各物质的质量不再变化,再通过分析曲线图可知;
(2)曲线图所示的反应物质质量的减少,正是反应生成的气体挥发的结果;
(3)根据反应的化学方程式,得出各物质之间的比值关系,再由溶质的质量分数=×100%,先计算出所需数据,再进行计算.
解答 解:(1)由反应曲线图可知,从15分钟时开始,曲线呈平直状态,说明反应已完全,故当固体混合物与稀盐酸恰好完全反应时,所需时间约为15S,
故答案为:15;
(2)由图示可知,完全反应后,纵坐标表示的药品质量为195.6,而未反应前是200,减少的部分正是反应过程中生成的二氧化碳气体的质量,故完全反应后,产生二氧化碳气体质量为200g-195.6g=4.4g,
故答案为:4.4;
(3)设14.9g固体粉末中含Na2CO3 xg,反应生成NaClyg
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 117 44
x y 4.4
∴x=10.6(g) y=11.7(g)
∴完全反应后,所得溶液中溶质的质量为:14.9-10.6+11.7=16(g)
完全反应后所得溶液的质量为:14.9+149.5-4.4=160(g)
∴所得溶液中溶质的质量分数为:$\frac{16}{160}×100%$=10%;
故答案为:(1)15;(2)4.4;(3)答:所得溶液中溶质的质量分数为10%.
点评 本题主要测试学生对物质完全反应的认识,以及对溶质质量分数的计算能力,学生只有认真分析图示,掌握完全反应的特点,并能熟练计算,才能解答.

练习册系列答案
相关题目
7.下列有关元素化合物的叙述正确的是( )
| A. | 钠在空气中燃烧生成淡黄色的氧化钠固体 | |
| B. | 盛有氯气的集气瓶中加入干燥有色布条后,C12可以使有色布条褪色 | |
| C. | 检验FeCl2溶液中的少量Fe3+,可以用KSCN溶液 | |
| D. | C60、金刚石、石墨都是碳的同素异形体,它们之间的转化属于物理变化 |
4.下列说法正确的是( )
| A. | 硅材料广泛用于光纤通讯 | |
| B. | 工艺师利用盐酸刻蚀石英制作艺术品 | |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| D. | 化学家采用玛瑙研砵磨擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐 |
11.25℃时,10mL 0.1mol•L-1 的一元酸HA溶液,在水中约有0.1%发生电离(每1000个HA只有1个HA电离),下列叙述不正确的是( )
| A. | 该溶液的pH约是4 | |
| B. | HA一定是一种弱酸 | |
| C. | 恰好中和时消耗NaOH的物质的量是10-6mol | |
| D. | 与足量Mg完全反应生成标准状况下气体的体积可能是11.2 mL |
1.下列不能说明氯的非金属性比硫强的事实是( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤在与钠反应时,S原子得到的电子数更多 ⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS ⑦HCl酸性比H2S强.
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤在与钠反应时,S原子得到的电子数更多 ⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS ⑦HCl酸性比H2S强.
| A. | ②⑤⑦ | B. | ①②⑦ | C. | ②④ | D. | ①③⑤ |
8.向一定浓度的下列物质澄清溶液中通入过量的CO2气体,最后肯定没有沉淀生成的是( )
①Ca(OH)2 ②Na2CO3 ③CaCl2 ④Ca(ClO)2⑤Na2SiO3.
①Ca(OH)2 ②Na2CO3 ③CaCl2 ④Ca(ClO)2⑤Na2SiO3.
| A. | ①③④ | B. | ②③④⑤ | C. | ①②③ | D. | ①②③④ |