题目内容
下列对应物质变化的解释正确的是( )
| A、NaHCO3水解:HCO3-+H2O?CO32-+H3O+ | ||||
| B、H2S与CuSO4反应生成H2SO4:酸性 H2S>H2SO4 | ||||
| C、石灰水溶解在醋酸溶液中:2H++CO32-=H2O+CO2↑ | ||||
D、2C+SiO2
|
考点:盐类水解的应用,非金属在元素周期表中的位置及其性质递变的规律,弱电解质在水溶液中的电离平衡
专题:基本概念与基本理论
分析:A、NaHCO3水解时HCO3-结合水电离的氢离子;
B、CuS不溶于硫酸;
C、醋酸是弱酸,要写成分子;
D、该反应生成的CO为气体,产物CO挥发,生成物浓度减小,平衡正移.
B、CuS不溶于硫酸;
C、醋酸是弱酸,要写成分子;
D、该反应生成的CO为气体,产物CO挥发,生成物浓度减小,平衡正移.
解答:
解:A、NaHCO3水解时HCO3-结合水电离的氢离子,NaHCO3水解离子反应为HCO3-+H2O?H2CO3+OH-,故A错误;
B、CuS不溶于硫酸,H2S与CuSO4反应生成H2SO4和CuS沉淀,符合复分解反应的条件,不能说明酸性硫化氢比硫酸强,故B错误;
C、醋酸是弱酸,要写成分子,则石灰水溶解在醋酸溶液中:CH3COOH+OH-=H2O+CH3COO-,故C错误;
D、非金属Si<C,2C+SiO2
Si+2CO,该反应生成的CO为气体,产物CO挥发,生成物浓度减小,平衡正移,所以反应发生可用平衡原理解释,故D正确.
故选D.
B、CuS不溶于硫酸,H2S与CuSO4反应生成H2SO4和CuS沉淀,符合复分解反应的条件,不能说明酸性硫化氢比硫酸强,故B错误;
C、醋酸是弱酸,要写成分子,则石灰水溶解在醋酸溶液中:CH3COOH+OH-=H2O+CH3COO-,故C错误;
D、非金属Si<C,2C+SiO2
| ||
故选D.
点评:本题考查了盐的水解、复分解反应的条件、离子方程式、反应原理,题目涉及的知识点较多,题目难度不大,注意对基础知识的积累.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
下列离子方程式书写正确的是( )
| A、氯气通入冷的氢氧化钠溶液中 Cl2+2OH-═Cl-+ClO-+H2O |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ |
| D、铝片跟氢氧化钠溶液反应 Al+2OH-=AlO2-+H2↑ |
下列事实不能用勒夏特利原理来解释的是( )
| A、用排饱和食盐水的方法收集氯气 |
| B、合成氨工业选择高温 |
| C、增大压强,有利于SO2和O2反应生成SO3 |
| D、在Fe3++3SCN -?Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深 |
 的平衡体系中加入H218O,过一段时间后18O存在的有机物( )
的平衡体系中加入H218O,过一段时间后18O存在的有机物( )| A、只存在于乙酸分子中 |
| B、只存在于乙醇分子中 |
| C、存在于乙酸和乙酸乙酯分子中 |
| D、只存在于乙酸、乙醇和乙酸乙酯分子中 |
 向一无色透明的溶液中滴加稀硫酸时有沉淀生成,且所得沉淀量与所加硫酸的关系如图所示,则原溶液可能是( )
向一无色透明的溶液中滴加稀硫酸时有沉淀生成,且所得沉淀量与所加硫酸的关系如图所示,则原溶液可能是( )| A、Na2SiO3与Na2CO3的混合溶液 |
| B、Na2S和Na2SO3的混合溶液 |
| C、NaAlO2与Na2SiO3的混合溶液 |
| D、Na2SO3与Na2SiO3的混合溶液 |
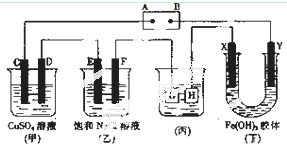 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向乙中滴入酚酞液,在F极附近显红色.
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向乙中滴入酚酞液,在F极附近显红色. 1866年凯库勒(图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列( )事实.
1866年凯库勒(图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列( )事实.