题目内容
2.用如图装置进行相应实验,不能达到实验目的是( )
| A. | 图1所示装置可制备氢氧化亚铁 | |
| B. | 图2所示装置可电解食盐水制氢气和Cu(OH)2 | |
| C. | 图3所示装置可验证氨气极易溶于水 | |
| D. | 图4所示装置用于Cu和浓硫酸反应制取少量的SO2气体 |
分析 A.苯能隔绝空气,防止氢氧化亚铁被氧化;
B.Cu为阳极,失去电子;
C.挤压胶头滴管,氨气溶于水,气球变大;
D.浓硫酸和铜应在加热条件下进行.
解答 解:A.苯能隔绝空气,防止氢氧化亚铁被氧化,则图1所示装置可制备氢氧化亚铁,故A正确;
B.Cu为阳极,失去电子,氢离子得电子生成氢气,铜离子和氢氧根反应生成Cu(OH)2,故B正确;
C.挤压胶头滴管,氨气溶于水,气球变大,则图3所示装置可验证氨气极易溶于水,故C正确;
D.浓硫酸和铜应在加热条件下进行,该装置不能继而制备气体,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的制备、电解原理、物质的性质及除杂等,把握物质的性质及反应原理为解答的关键,侧重实验技能的考查,注意操作的可行性、评价性分析,题目难度不大.

练习册系列答案
相关题目
12.不能用排水收集法收集的气体是( )
| A. | 氢气 | B. | 氧气 | C. | 二氧化氮 | D. | 一氧化氮 |
13.下列反应的离子方程式书写中,正确的是( )
| A. | 金属钠溶于水:Na+H2O═Na++OH-+H2↑ | |
| B. | 向AlCl3溶液中加入过量氨水:Al3++4OH-═[Al(OH)4]- | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | Cl2溶于水:Cl2+H2O═2H++Cl-+ClO- |
10.下列反应不属于可逆反应的是( )
| A. | CO2+H2O→H2CO3 | B. | H2+I2→HI | C. | NH3+HCl→NH4Cl | D. | SO2+O2→SO3 |
17.化学与科技、生活、资源的综合利用、环境密切相关,下列说法不正确的是( )
| A. | 煤的综合利用主要是煤的干馏、液化和气化,气化是指:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | |
| B. | 高温结构陶瓷氮化硅(Si3N4),属于新型无机非金属材料,可用于制造汽车发动机 | |
| C. | 用铝质铆钉来焊接铁板,铁板易被腐蚀 | |
| D. | 用铜、稀硫酸、过氧化氢混合制硫酸铜法体现了“绿色化学”的思想 |
2.下列叙述正确的是( )
| A. | 某溶液的pH<7,说明该溶液一定呈酸性 | |
| B. | 常温时pH=3的盐酸溶液与pH=5盐酸溶液等体积混合后溶液的pH=4 | |
| C. | 0.2 mol•L-1的盐酸,与等体积水混合后pH=1 | |
| D. | 常温时pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
9.下列判断正确的是( )
| A. | 同体积、同浓度的NaF和NaCl溶液中,所有离子总数,N(NaCl)>N(NaF);同体积同浓度的Na2CO3和Na2SO4溶液中,所有离子总数,N(Na2CO3)>N(Na2SO4) | |||||||||||
| B. | 以下是某温度下高氯酸、硫酸、硝酸和盐酸在冰醋酸中的电离常数,则在冰醋酸中硫酸的电离方程式可表示为H2SO4?2H++SO42-
| |||||||||||
| C. | 已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] | |||||||||||
| D. | 平衡体系CaCO3(s)?CaO(s)+CO2中仅含有碳酸钙、氧化钙及二氧化碳气体.某时刻,保持温度不变,将容器体积缩小为原来的一半并保持不变,则二氧化碳浓度增大 |
6.在汽车尾气处理装置中加入某种催化剂,发生如下反应:4CO+2NO2═4CO2+N2.下列对该反应的说法中错误的是( )
| A. | 该反应中氧化剂是CO、还原剂是NO2 | |
| B. | 该反应是氧化还原反应 | |
| C. | 该反应生成28 g N2时,转移8 mol e- | |
| D. | 该反应能减少汽车尾气对环境的污染 |
7.2015年10月,中国科学家屠呦呦因为创制了新型抗疟药--青蒿素,获得诺贝尔生理学或医学奖.青蒿素可由香茅醛为原料制取,下列说法不正确的是( )
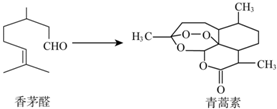

| A. | 香茅醛能使Br2的CCl4溶液褪色 | |
| B. | 青蒿素分子式为C15H22O5 | |
| C. | 青蒿素在一定条件下可发生水解反应 | |
| D. | 二者均可与氢气发生加成反应 |