题目内容
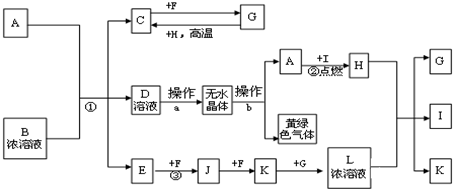
已知A~O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去).A、B、H分别是由短周期元素组成的单质.B与冷水缓慢反应,与沸水迅速反应,放出氢气.D是一种离子化合物,其阴阳离子的个数比为2?:3,且能与水反应得到两种碱.C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀.
请回答下列问题:
(1)组成B单质的元素位于周期表第 周期,第 族.化合物C的电子式为 .
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是 .
(3)写出I与H在点燃条件下反应生成A和J的化学方程式: .
(4)写出D与足量的N反应生成E和F的化学方程式: .
(5)图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有 个.

请回答下列问题:
(1)组成B单质的元素位于周期表第
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:
(4)写出D与足量的N反应生成E和F的化学方程式:
(5)图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有
考点:无机物的推断
专题:
分析:B是由短周期元素组成的单质,B与冷水缓慢反应,与沸水迅速反应,放出氢气,可判断B为金属镁.D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反应得到两种碱,可以判断D为氮化镁,所以A为氮气. C为淡黄色固体化合物,可确定C为Na2O2.C与J反应得到G与H,O能与G的水溶液反应生成蓝色沉淀,说明有氢氧化铜生成,则G为NaOH,故J为H2O,H为O2,G与F反应得到K、I与水,且I连续与氧气反应生成M,M与水反应生成L与N,N能与Cu反应生成铜盐,故N为HNO3,则E为Mg(NO3)2,F为NH4NO3,K为NaNO3,I为NH3,故L为NO,M为NO2,O为Cu(NO3)2,据此解答.
解答:
解:B是由短周期元素组成的单质,B与冷水缓慢反应,与沸水迅速反应,放出氢气,可判断B为金属镁.D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反应得到两种碱,可以判断D为氮化镁,所以A为氮气. C为淡黄色固体化合物,可确定C为Na2O2.C与J反应得到G与H,O能与G的水溶液反应生成蓝色沉淀,说明有氢氧化铜生成,则G为NaOH,故J为H2O,H为O2,G与F反应得到K、I与水,且I连续与氧气反应生成M,M与水反应生成L与N,N能与Cu反应生成铜盐,故N为HNO3,则E为Mg(NO3)2,F为NH4NO3,K为NaNO3,I为NH3,故L为NO,M为NO2,O为Cu(NO3)2,
(1)组成B单质的元素为Mg元素,原子核外有3个电子层,最外层电子数为2,则应位于周期表第三周期ⅡA族,C为Na2O2,为离子化合物,电子式为 ,
,
故答案为:三;ⅡA; ;
;
(2)J为H2O,水分子之间存在氢键且化硒化氢的分子间作用力强,故其沸点比硒化氢(H2Se)的沸点高,
故答案为:水分子之间存在氢键且化硒化氢的分子间作用力强;
(3)由题意可知,NH3在O2中点燃生成N2和H2O,则反应的化学方程式为4NH3+3O2
2N2+6H2O,
故答案为:4NH3+3O2
2N2+6H2O;
(4)D与足量的N反应生成E和F的化学方程式为:Mg3N2+8HNO3=3Mg(NO3)2+2NH4NO3,
故答案为:Mg3N2+8HNO3=3Mg(NO3)2+2NH4NO3;
(5)上图中,在同一反应里一种物质既作氧化剂,又作还原剂反应有:2Na2O2+2H2O=4NaOH+O2↑,3NO2+H2O=2HNO3+NO,共2个反应,故答案为:2.
(1)组成B单质的元素为Mg元素,原子核外有3个电子层,最外层电子数为2,则应位于周期表第三周期ⅡA族,C为Na2O2,为离子化合物,电子式为
 ,
,故答案为:三;ⅡA;
 ;
;(2)J为H2O,水分子之间存在氢键且化硒化氢的分子间作用力强,故其沸点比硒化氢(H2Se)的沸点高,
故答案为:水分子之间存在氢键且化硒化氢的分子间作用力强;
(3)由题意可知,NH3在O2中点燃生成N2和H2O,则反应的化学方程式为4NH3+3O2
| ||
故答案为:4NH3+3O2
| ||
(4)D与足量的N反应生成E和F的化学方程式为:Mg3N2+8HNO3=3Mg(NO3)2+2NH4NO3,
故答案为:Mg3N2+8HNO3=3Mg(NO3)2+2NH4NO3;
(5)上图中,在同一反应里一种物质既作氧化剂,又作还原剂反应有:2Na2O2+2H2O=4NaOH+O2↑,3NO2+H2O=2HNO3+NO,共2个反应,故答案为:2.
点评:本题考查无机物的推断,题目难度中等,本题中的几个突破口:①B与冷水缓慢反应,与沸水迅速反应,放出氢气,②D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱,③C为淡黄色固体化合物,④蓝色沉淀,再结合转化关系推断,需要学生具备扎实的基础.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
由Fe O、Fe2O3、Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21:8,则这种混合物中FeO、F203、Fe304的物质的量之比可能是( )
①1:2:1 ②2:1:1 ③1:1:1 ④1:1:3 ⑤2:2:3.
①1:2:1 ②2:1:1 ③1:1:1 ④1:1:3 ⑤2:2:3.
| A、①③ | B、③④⑤ | C、②③ | D、全部 |
配制200mL0.1mol/L稀硫酸时,下列实验操作使得所配溶液浓度偏小的是( )
| A、用量筒量取所需的浓硫酸时仰视读数 |
| B、定容后摇匀,发现液面最低点低于刻度线,再补加几滴蒸馏水至刻度线 |
| C、定容时,俯视刻度线 |
| D、未冷却至室温就进行后续操作 |
下列操作正确的是( )
| A、给试管内的液体加热,可使试管口对准自己,不能使试管口对准别人 |
| B、用KMnO4制取O2时,先检验装置的气密性,然后再加药品 |
| C、把NaOH固体直接放在天平的左盘上称量 |
| D、稀释浓H2SO4时,可向盛浓H2SO4的量筒中小心加水 |

 +R′-M′gX→
+R′-M′gX→
 (R,R′均为烃基)
(R,R′均为烃基)