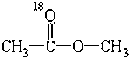
题目内容
温度相同、浓度均为0.2mol/L的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤NaHCO3、⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )
| A、③①④②⑥⑤ |
| B、①③⑥④②⑤ |
| C、③②①⑥④⑤ |
| D、⑤⑥②④①③ |
考点:溶液pH的定义,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:溶液中氢离子浓度越大,溶液的pH越小,根据盐类水解的酸碱性和水解程度比较溶液的pH大小关系.
解答:
解:①(NH4)2SO4、④NH4NO3水解呈酸性,pH<7;前者c(NH4+)大,水解生成c(H+)大,pH小,即①<④;
③NH4HSO4电离出H+呈酸性,pH<7,且小于①④的pH;
②NaNO3不水解,pH=7;
⑤NaHCO3、⑥CH3COONa水解呈碱性,pH>7,醋酸酸性大于碳酸酸性,碳酸氢钠水解程度大,pH大,即⑤>⑥;
所以pH大小关系为:③①④②⑥⑤,
故选A.
③NH4HSO4电离出H+呈酸性,pH<7,且小于①④的pH;
②NaNO3不水解,pH=7;
⑤NaHCO3、⑥CH3COONa水解呈碱性,pH>7,醋酸酸性大于碳酸酸性,碳酸氢钠水解程度大,pH大,即⑤>⑥;
所以pH大小关系为:③①④②⑥⑤,
故选A.
点评:本题考查溶液PH的大小比较,题目难度不大,要考虑盐类的水解程度大小,注意硫酸氢铵中硫酸氢根离子电离出氢离子.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
 某离子晶体的晶胞结构如图所示,则该离子晶体的化学式为( )
某离子晶体的晶胞结构如图所示,则该离子晶体的化学式为( )| A、AB12C8 |
| B、ABC3 |
| C、AB2C3 |
| D、AB3C |
氰气的化学式为(CN)2,结构式为N≡C-C≡N,性质与卤素相似,下列叙述正确的是( )
| A、分子中既有极性键,又有非极性键 |
| B、分子中N≡C键的键长大于C-C键的键长 |
| C、分子中含有2个σ键和4个π键 |
| D、不和氢氧化钠溶液发生反应 |
设NA表示阿佛加德罗常数的值,下列叙述中一定正确的是( )
| A、1molFeCl3制成胶体,所得胶体的粒子数为NA | ||
B、常温常压下乙烯和丁烯混合气a克,其中C-H键的数目为
| ||
| C、0.5mol/L 1升Al(NO3)3溶液中,Al3+的数目为0.5NA | ||
| D、标准状况下,22.4升庚烷中含碳原子数为7NA |
实验室中配制250mL 0.20mol?L-1NaOH溶液时,必须使用到的玻璃仪器是( )
A、 试管 |
B、 锥形瓶 |
C、 容量瓶 |
D、 分液漏斗 |