题目内容
4.下列物质:①鸡汤②矿泉水③酒精④生理盐水⑤面汤,不属于溶液的是( )| A. | ③④ | B. | ②③⑤ | C. | ①③⑤ | D. | ②④ |
分析 根据溶液的概念分析,在一定条件下溶质分散到溶剂中形成的是均一稳定的混合物是溶液.
解答 解:①鸡汤不均一、不稳定,属于悬浊液;②矿泉水属于均一稳定的混合物,属于溶液;③酒精由一种物质组成,属于纯净物,不属于溶液;④生理盐水属于均一稳定的混合物,属于溶液;⑤面汤不均一、不稳定,属于悬浊液.
故选C.
点评 本题考查溶液的辨别,应熟悉溶液是一种均一稳定的混合物,在不改变条件时,溶液的组成和浓度都不会发生变化,要与悬浊液和乳浊液区分,题目难度不大.

练习册系列答案
相关题目
14.若不断地升高温度,实现“液氨→氨气→氮气和氢气→氮原子和氢原子“的变化.在变化的各阶段被破坏的粒子间主要的相互作用是( )
| A. | 氢键;分子间作用力;非极性键 | B. | 氢键;极性键;非极性键 | ||
| C. | 氢键;极性键;分子间作用力 | D. | 分子间作用力;氢键;非极性键 |
15.A、B、C是周期表中相邻的三种主族元素,A和B同周期,B和C同主族,三种元素原子最外层电子数之和恰好为核内质子之和的$\frac{1}{2}$.则A、B、C三种元素分别是( )
| A. | N O P | B. | Li Be Mg | C. | C N P | D. | Ar Cl F |
12.下列有关离子反应的方程式书写正确的是( )
| A. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ | |
| B. | 等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O | |
| C. | 氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
9.某小组同学按图所示流程进行实验,用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,请你参与讨论并回答相关问题.

(1)贝壳高温煅烧时,发生反应的化学方程式是CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)固体A和还原铁粉是食品包装袋中常用的两种干燥剂.
①可区分两种干燥剂的简单物理方法是用磁铁吸引;
②操作Ⅰ中用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是使液体受热均匀,防止液滴外溅;
【问题与发现】该小组同学所得到固体C一定是纯净的NaOH吗?
【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的NaOH;乙:NaOH和Na2CO3的混合物;丙:NaOH和Ca(OH)2的混合物
【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.他们的实验操作、现象和结论记录如下表,请参与他们的探究并完成所缺内容.
【反思与评价】根据实验流程,可以判定甲同学设计的方案不严密,理由是:因为碳酸钠、氢氧化钙的水溶液都显碱性,无论碳酸钠过量还是氢氧化钙过量,混有碳酸钠或氢氧化钙的氢氧化钠配成溶液后,都能够使酚酞试液变红色,所以酚酞试液变红色,不能说明是纯净的氢氧化钠.

(1)贝壳高温煅烧时,发生反应的化学方程式是CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)固体A和还原铁粉是食品包装袋中常用的两种干燥剂.
①可区分两种干燥剂的简单物理方法是用磁铁吸引;
②操作Ⅰ中用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是使液体受热均匀,防止液滴外溅;
【问题与发现】该小组同学所得到固体C一定是纯净的NaOH吗?
【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的NaOH;乙:NaOH和Na2CO3的混合物;丙:NaOH和Ca(OH)2的混合物
【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.他们的实验操作、现象和结论记录如下表,请参与他们的探究并完成所缺内容.
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量稀硫酸 | 无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和碳酸钠溶液 | 出现白色沉淀 | 猜想成立 |
16.某塑料的中间体M的结构简式为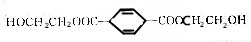 ,有关说法错误的是( )
,有关说法错误的是( )
 ,有关说法错误的是( )
,有关说法错误的是( )| A. | M的分子式为C12H16O6 | |
| B. | 含有的官能团为羟基、酯基和碳碳双键 | |
| C. | 能发生酯化、水解、加成、氧化等反应 | |
| D. | 1molM能与3molH2加成 |
7.还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
CrO42-$\underset{\stackrel{{H}^{+}}{→}}{转换}$Cr2O72-$\underset{\stackrel{F{e}^{2+}}{→}}{还原}$Cr3+$\underset{\stackrel{O{H}^{-}}{→}}{沉淀}$Cr(OH)3↓
已知转化过程中的反应为2CrO42-(aq)+2H+(aq)?Cr2O72-(aq)+H2O(1)
转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2072-,下列说法不正确的是( )
CrO42-$\underset{\stackrel{{H}^{+}}{→}}{转换}$Cr2O72-$\underset{\stackrel{F{e}^{2+}}{→}}{还原}$Cr3+$\underset{\stackrel{O{H}^{-}}{→}}{沉淀}$Cr(OH)3↓
已知转化过程中的反应为2CrO42-(aq)+2H+(aq)?Cr2O72-(aq)+H2O(1)
转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2072-,下列说法不正确的是( )
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeS04•7H2O)作还原剂,处理1 L废水,至少需要458.7g | |
| C. | 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5 | |
| D. | 常温下Ksp=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
8.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1mol二甲醚中含有的C-O键的数目为2NA | |
| B. | 标准状况下,44.8LHF中含有分子的数目为2NA | |
| C. | 200g质量分数为23%的HCOOH水溶液中含氧原子的总数目为2NA | |
| D. | 在反应Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2中,每生成1molCu,转移电子的数目为2NA |
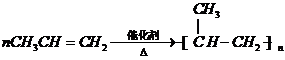 ,
, ,
,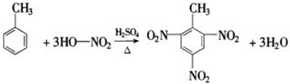 .
.