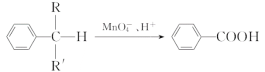
题目内容
【题目】铅蓄电池是典型的可充电电池,电池总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。回答下列问题:
2PbSO4+2H2O。回答下列问题:
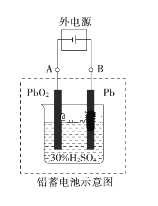
(1)放电时,负极为_______电极,试写出该电极的电极反应式是___________。电解液中H2SO4的浓度将变____________。(填“升高”、 “降低” 或“不变”)
(2)电池放电时,当外电路通过0.1 mol电子时,理论上负极板的质量增加________g,电池中消耗的硫酸物质的量为_______mol。
【答案】Pb Pb-2e-+SO42-=PbSO4 降低 4.8 0.1
【解析】
(1)从总反应Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O看,Pb化合价从0价升高到+2价,其为负极材料;在反应中,Pb最终转化为PbSO4,负极反应式为Pb-2e-+SO42-=PbSO4;正极PbO2也将转化为PbSO4,正极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O,两电极都消耗H2SO4。
2PbSO4+2H2O看,Pb化合价从0价升高到+2价,其为负极材料;在反应中,Pb最终转化为PbSO4,负极反应式为Pb-2e-+SO42-=PbSO4;正极PbO2也将转化为PbSO4,正极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O,两电极都消耗H2SO4。
(2)电池放电时,可建立如下关系式:Pb——2e-——2H2SO4,由外电路通过0.1 mol电子,可求出负极板的质量增加和电池中消耗的硫酸物质的量。
(1)放电时,Pb化合价从0价升高到+2价,其为负极材料,该电极的电极反应式是Pb-2e-+SO42-=PbSO4。两电极都消耗H2SO4,所以电解液中H2SO4的浓度将降低。答案为:Pb;Pb-2e-+SO42-=PbSO4;降低;
(2)电池放电时,可建立如下关系式:Pb——2e-——2H2SO4,当外电路通过0.1 mol电子时,理论上负极板由Pb转化为PbSO4,质量增加![]() =4.8g,电池中消耗的硫酸物质的量为0.1mol。答案为:4.8;0.1。
=4.8g,电池中消耗的硫酸物质的量为0.1mol。答案为:4.8;0.1。

【题目】Ⅰ.已知某可逆反应:aA(g)+bB(g) ![]() cC(g)+dD(g)。请回答下列问题:
cC(g)+dD(g)。请回答下列问题:
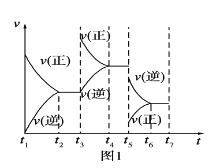
(1)根据实验测定结果,描绘出了该反应达到平衡状态时及改变外界条件后,反应速率与时间的关系图像(如图1所示),有利于提高D产量的变化过程是图像中的______段;引起该变化过程的外界条件是_________________________________________。
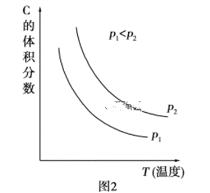
(2)根据实验测定结果描绘出了图2。由此图像可以得出,升高温度,上述平衡将向____(填“正反应”或“逆反应”)方向移动;反应计量数之间的关系:a+b______c+d(填“大于”、“小于”、“等于”或“不确定”)。
Ⅱ.工业合成氨反应如下:N2+3H2![]() 2NH3。请回答下列问题:
2NH3。请回答下列问题:
(1)在一定条件下2L的密闭容器中进行实验,并测得下列数据:
物质 | N2 | H2 | NH3 |
起始(mol) | 2 | 7 | 0 |
10s(mol) | 1.6 | ||
平衡时(mol) | 2 |
则10s内,用氢气表示的化学反应速率是______,该反应的化学平衡常数是________。
(2)根据混合气体各成分的物质性质,你认为工业上将氨气从混合气体中分离出来的措施是________,从而达到反应气体循环利用的目的。实验室检验氨气的方法是__________。