题目内容
将纯锌片和纯铜片按1-2-16所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )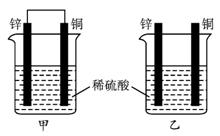
图1-2-16
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大 D.产生气泡的速度甲比乙慢
解析:本题主要考查构成原电池的条件。由题目所给图示可知,甲为原电池,Zn作负极发生反应:Zn-2e-=Zn2+,Cu作正极发生还原反应:2 H+2e-=H2↑,A不正确;乙不能构成原电池(没有形成闭合回路),只在锌上发生反应Zn+2 H+=Zn2++H2↑,B不正确;两烧杯中均消耗H+,故pH均增大,显然甲中气泡比乙快。
答案:C

练习册系列答案
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
(7分)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法正确的是____________。
| A.甲、乙均为化学能转变为电能的装置 |
| B.乙中铜片上没有明显变化 |
| C.甲中铜片质量减少、乙中锌片质量减少 |
| D.两烧杯中溶液的pH均增大 |
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为_______________。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至
1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫
酸的物质的量浓度为_________________。
 将纯锌片和纯铜片按如图方式插入100ml相同浓度的稀硫酸中一段时间,请回答下列问题:
将纯锌片和纯铜片按如图方式插入100ml相同浓度的稀硫酸中一段时间,请回答下列问题: 理论上讲,任何自发的氧化还原反应都可以设计成原电池.
理论上讲,任何自发的氧化还原反应都可以设计成原电池. 将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题: