题目内容
10.在下面的装置中,A是Cl2发生装置,C、D为气体净化装置;E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答:
(1)C、D两个装置中的试剂选择和作用分别是:
C饱和食盐水,作用除去Cl2中的HCl杂质;
D浓硫酸,作用干燥氯气.
(2)F的作用是防止发生倒吸.
(3)写出在A、E、G中发生反应的化学方程式为:
A:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
E:3Cl2+2Fe$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
G:Cl2+2NaOH═NaCl+NaClO+H2O.
分析 二氧化锰与浓盐酸在加热条件下生成氯气和氯化锰和水,浓盐酸易挥发制取的氯气中含有氯化氢和水,依据氯气和氯化氢的水溶性选择合适的除杂剂,浓硫酸具有吸水性,可以干燥氯气,干燥的氯气与铁反应生成氯化铁,氯气有毒,不能直接排放到空气,氯气能够与氢氧化钠反应生成氯化钠和次氯酸钠,可用氢氧化钠吸收过量的氯气,据此解答.
解答 解:(1)实验制备氯气中含杂质气体氯化氢和水蒸气,氯化氢易溶于饱和氯化钠溶,而饱和氯化钠溶液中含有大量的氯离子,抑制氯气的溶解,通过饱和食盐水的C可以除去氯气中的氯化氢,浓硫酸具有吸水性,通过盛有浓硫酸的D可以除去氯气中的水蒸气;
故答案为:饱和食盐水;除去Cl2中的HCl杂质;浓硫酸;干燥Cl2;
(2)氯气易与氢氧化钠溶液反应,发生倒吸,据此判断F装置的作用安全瓶,防止发生倒吸;
故答案为:防止发生倒吸;
(3)A中二氧化锰与浓盐酸在加热条件下生成氯气和氯化锰和水,方程式:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
E中氯气与铁反应生成氯化铁,化学方程式:3Cl2+2Fe$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
G中氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH═NaCl+NaClO+H2O;
故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;3Cl2+2Fe$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;Cl2+2NaOH═NaCl+NaClO+H2O.
点评 本题考查了氯气的制备和性质检验,明确氯气制备原理及氯气性质是解题关键,题目难度不大.

| A. | K+、Ba2+、NO3-、CO32- | B. | Cu2+、K+、NO3-、SO42- | ||
| C. | Na+、K+、Cl-、SO42- | D. | Fe2+、H+、Cl-、NO3- |
| A. | 等质量的N2和CO所含分子数均为NA | |
| B. | 一定温度下,1 L 1 mol•L-1的CH3COONa溶液含NA个CH3COO- | |
| C. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 | |
| D. | 在标准状况下,22.4 L CH4与18 g H2O所含的电子数均为10NA |
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 铜粉与稀硝酸的反应:Cu+2H+═Cu2++H2↑ | |
| C. | 氢氧化铜与稀盐酸反应:OH-+H+═H2O | |
| D. | 碳酸钠溶液与足量稀硫酸的反应:CO32-+2H+═H2O+CO2↑ |
| A. | 将苯与浓硝酸、浓硫酸的混合物在100℃水浴加热条件下反应可生成硝基苯 | |
| B. | 用酸性高锰酸钾溶液即可检验CH2═CH-CHO中的碳碳双键 | |
| C. | 将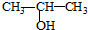 与NaOH的醇溶液共热制备CH3-CH═CH2 与NaOH的醇溶液共热制备CH3-CH═CH2 | |
| D. | 利用核磁共振氢谱,可以鉴别CH3OCH3和CH3CH2OH |
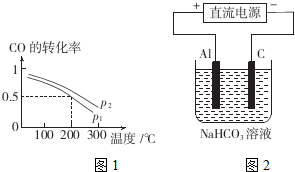
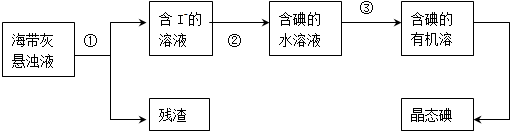
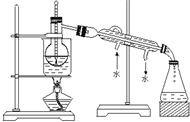

 “低碳循环”引起了全世界的高度重视,减排CO2的一种方法是:
“低碳循环”引起了全世界的高度重视,减排CO2的一种方法是: