题目内容
【题目】研究或认识物质的化学性质一般可从以下几个方面入手(以SiO2为例)。
(1)从物质分类角度分析可能具有的通性,如酸性、碱性等。
SiO2属于__________氧化物(填“酸性”“碱性”或“两性”)。盛装NaOH 等碱性溶液的试剂瓶不能用玻璃塞,其原因可用离子方程式表示为____________________________。
(2)从核心元素化合价角度分析可能具有氧化性、还原性。
①据SiO2中Si元素的价态可推知SiO2_____________(填字母):
A.只有还原性 B.只有氧化性 C.既有还原性又有氧化性
②工业上用石英砂和焦炭混合高温制取粗硅,其反应为:SiO2+2C![]() Si+2CO↑
Si+2CO↑
用双线桥法标出电子转移方向与数目:____________________________。
(3)从其它角度认识可能具有的特性。
SiO2能与唯一的酸____________ (填物质名称或化学式)反应,工艺上常利用该反应___________(填一种用途)。
【答案】 酸性 SiO2+2OH-=SiO32-+H2O B  氢氟酸 刻蚀玻璃
氢氟酸 刻蚀玻璃
【解析】(1)SiO2能与碱反应生成盐和水,二氧化硅属于酸性氧化物。氢氧化钠能与二氧化硅反应生成黏性很强的硅酸钠,所以盛装NaOH等碱性溶液的试剂瓶不能用玻璃塞,反应的离子方程式为SiO2+2OH-=SiO32-+H2O。(2)①SiO2中Si元素的价态是+4价,处于最高价,因此可推知SiO2只有氧化性,答案选B。②碳元素化合价从0价升高到+2价,失去2个电子,Si元素化合价从+4价降低到0价,得到4个电子,则电子转移方向与数目可表示为 。(3)SiO2能与唯一的酸氢氟酸反应生成四氟化硅与水,工艺上常利用该反应刻蚀玻璃。
。(3)SiO2能与唯一的酸氢氟酸反应生成四氟化硅与水,工艺上常利用该反应刻蚀玻璃。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
实验 | 金属 | 金属 | c(H2SO4) mol/L | 实验 | 金属消失 | |
1 | 0.10 | 丝 | 0.7 | 20 | 250 | |
2 | 0.10 | 丝 | 1.0 | 20 | 200 | |
3 | 0.10 | 粉末 | 1.0 | 20 | 125 | |
4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
分析上述数据,回答下列问题:
(1)反应的离子方程式:;
(2)①实验1、2可得出的结论是,硫酸浓度越 , 反应速率越慢;
②实验2、3可得出的结论是反应物接触面越大,反应速率越;
③实验3、4可得出的结论是温度越 , 反应速率越快.
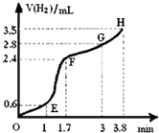
(3)①用铁粉和稀硫酸反应制取H2 , 实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示. 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、v (GH)表示)最快时段是 .
A.v (OE) B.v (EF)
C.v (FG) D.v (GH)
②1min内反应较慢的原因是:;一段时间后反应明显加快的原因是 .