题目内容
20.下列物质分类正确的是( )①混合物:铝热剂、碱石灰、水玻璃
②化合物:氯化钙、烧碱、胆矾
③酸性氧化物:Mn2O7、N2O3、SiO2
④碱性氧化物:Na2O2、CuO、Al2O3
⑤同素异形体:C60、C70、石墨⑥强电解质:BaSO4、MgO、Ba(OH)2.
| A. | ①②③⑤⑥ | B. | ②③④⑥ | C. | ①②④⑤ | D. | ①②④⑥ |
分析 ①不同物质组成的为混合物,
②不同元素组成的纯净物为化合物,
③和碱反应生成盐和水的氧化物为酸性氧化物,
④和酸反应生成盐和水的氧化物为碱性氧化物,
⑤同种元素组成的不同单质为同素异形体,
⑥水溶液中或熔融状态下完全电离的电解质为强电解质.
解答 解:①铝热剂是铝和铁组成的混合物、碱石灰是氧化钙和氢氧化钠组成的混合物、水玻璃是硅酸钠水溶液,都是混合物,故①正确
②氯化钙、烧碱、胆矾都是一种物质组成的纯净物,都是不同元素组成的化合物,故②正确
③Mn2O7、N2O3、SiO2都能和碱反应生成盐和水属于酸性氧化物,故③正确;
④Na2O2和酸反应生成盐、水和氧气,不是碱性氧化物,CuO和酸反应生成盐和水属于碱性氧化物,Al2O3和酸碱都反应生成盐和水,属于两性氧化物,故④错误,
⑤同素异形体:C60、C70、石墨是碳元素的不同单质属于同素异形体,故⑤正确,
⑥强电解质:BaSO4、MgO熔融状态下完全电离,Ba(OH)2水溶液中完全电离,都是强电解质,故⑥正确,
所以①②③⑤⑥正确,
故选A.
点评 本题考查了物质分类、物质组成和名称、氧化物分类和性质、电解质和非电解质、强电解质和弱电解质的判断,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
9.关于反应11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4的说法正确的是( )
| A. | 既是氧化剂又是还原剂,CuSO4只是还原剂 | |
| B. | Cu3P既是氧化产物又是还原产物 | |
| C. | 1 mol CuSO4可以氧化$\frac{1}{5}$mol P | |
| D. | 若有11 mol P参加反应,转移电子的物质的量为60 mol |
10.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 新制氯水:Na+、K+、NO${\;}_{3}^{-}$、NH3•H2O | |
| B. | 空气:CO、CO2、SO2、CH4 | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 浓高锰酸钾溶液;H+、Na+、SO${\;}_{4}^{2-}$、Cl- |
5.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd+2NiO(OH)+2H2O $?_{充电}^{放电}$ Cd(OH)2+2Ni(OH)2,下列叙述中正确的是( )
| A. | 该电池放电的时候,负极材料是Ni(OH)2 | |
| B. | 放电时每转移3mol的电子时,正极有3mol的NiO(OH)被氧化 | |
| C. | 充电时,阴极附近PH增大 | |
| D. | 充电时,阳极反应是Cd(OH)2+2e-=Cd+2 OH- |
12.某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液中,探究Fe2+和I-的还原性强弱.
假设1:Fe2+还原性比I-强.假设2:I-还原性比Fe2+强.
选择几种装置进行实验:
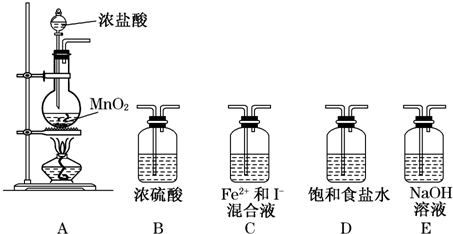
(1)实验必需的装置是A→C→E(按Cl2气流方向的顺序填写).
(2)请在下表中写出实验步骤及预期现象和结论.
(3)为了实验成功,必须控制各物质的量.该小组称取1.52g FeSO4固体,同时称取1.66g KI固体,溶于水中配成混合溶液.为了验证上述假设,通入的Cl2体积最多不能超过0.112L(标准状况).
(4)有同学质疑,上述实验中Cl2量很难控制,无法验证Fe2+和I-反应的先后顺序.于是提出另一方案:往KI溶液中滴入FeCl3溶液,如果能发生反应,即可证明I-的还原性强于Fe2+.
假设1:Fe2+还原性比I-强.假设2:I-还原性比Fe2+强.
选择几种装置进行实验:

(1)实验必需的装置是A→C→E(按Cl2气流方向的顺序填写).
(2)请在下表中写出实验步骤及预期现象和结论.
| 实验步骤 | 预期现象和结论 |
| 取少量反应后的混合溶液分别置于A、B两试管中:往A中滴加KSCN溶液;往B中滴加淀粉溶液 | ①A中溶液变红,B中溶液不变蓝, 则假设1成立. ②A中溶液不变红,B中溶液变蓝, 则假设2成立. |
(4)有同学质疑,上述实验中Cl2量很难控制,无法验证Fe2+和I-反应的先后顺序.于是提出另一方案:往KI溶液中滴入FeCl3溶液,如果能发生反应,即可证明I-的还原性强于Fe2+.
9.对于某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入稀盐酸无明显现象,再加入氯化钡溶液有白色沉淀产生,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ |
10. R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )
R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )
 R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )
R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )| A. | 最简单气态氢化物的热稳定性由强到弱的排序:Z、R、X、Y | |
| B. | 原子半径由小到大的排序:Z、A、Y、X | |
| C. | 最高价氧化物的水化物酸性由弱到强的排Z、R、A | |
| D. | RY3、A2X、ZA5分子中每个原子最外层都达到8 电子结构 |
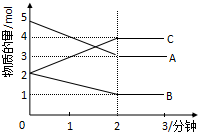 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是A、B,生成物是C,化学方程式为2A+B?2C;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为空,若不能,则其原因为无体积,无法求出浓度变化值;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了化学平衡状态.
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是A、B,生成物是C,化学方程式为2A+B?2C;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为空,若不能,则其原因为无体积,无法求出浓度变化值;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了化学平衡状态.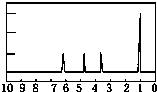 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: .
. +2H2O.
+2H2O.