题目内容
4.下列叙述正确的是( )| A. | 18OD-离子中,质子数、电子数、中子数之比为9:10:11 | |
| B. | H2O和CCl4分子中所有原子均满足最外层8电子结构 | |
| C. | 元素性质呈周期性变化的实质是元素化合价呈周期性变化 | |
| D. | 115号元素位于周期表第六周期第ⅤA族 |
分析 A.计算微粒中含有电子数、质子数、中子数进行解答,中子数=质量数-中子数;
B.元素化合价绝对值+原子最外层电子数=8,该元素原子满足8电子结构;
C.元素性质呈周期性变化的根本原因是核外电子排布呈周期性变化的必然结果;
D.第七周期稀有气体原子序数=18+18+18+32+32=118,是第七周期最后一种元素,位于18列,115号元素处于第15列.
解答 解:A.18OD-中质子数=8+1=9,电子数=8+1+1=10,中子数=(18-8)+(2-1)=11,故质子数、电子数、中子数之比为9:10:11,故A正确;
B.CCl4分子中所有原子均满足最外层为8电子结构,H2O中含有H原子不满足8电子结构,故B错误;
C.元素化合价属于元素性质,元素性质呈周期性变化的根本原因是核外电子排布呈周期性变化的必然结果,故C错误;
D.第七周期稀有气体原子序数=18+18+18+32+32=118,是第七周期最后一种元素,位于18列,115号元素处于第15列,故115号元素位于第七周期第ⅤA族,故D错误;
故选A.
点评 本题考查元素周期律、原子结构、周期表的结构与应用等,难度不大,注意掌握8电子结构判断.

练习册系列答案
相关题目
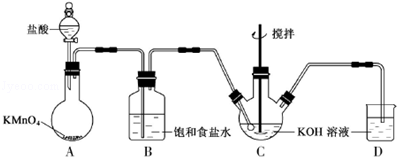
14.某同学用图甲所示装置及器材,测定碳酸钙与盐酸反应生成CO2气体体积随反应时间变化情况,并绘制出图乙所示曲线.有关分析不正确的是( )


| A. | CaCO3与盐酸的反应为放热反应 | |
| B. | 收集气体最多的时间段为t1~t2 | |
| C. | 平均反应速率:v(t1~t2)>v(t2~t3)>v(0~t1)>v(t3~t4) | |
| D. | 在t4后,收集到的CO2气体不再增加,一定是碳酸钙已完全反应 |
15.下列反应中生成物总能量高于反应物总能量的是( )
| A. | Ba(OH)2•8H2O与NH4Cl的反应 | B. | 乙烯与氧气的反应 | ||
| C. | 盐酸与NaOH溶液的反应 | D. | 铝粉与氧化铁粉末的铝热反应 |
12.以下反应最符合绿色化学原子经济性要求(即原子利用率为100%)的是( )
| A. | 乙烯聚合为聚乙烯高分子材料 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 以铜和浓硫酸为原料生产硫酸铜 | D. | 以铜和浓硝酸为原料生产硝酸铜 |
9.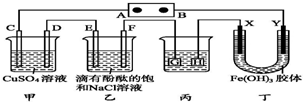 如图装置所示,C、D、E、F、X、Y都是惰性电极,A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.下列叙述正确的是( )
如图装置所示,C、D、E、F、X、Y都是惰性电极,A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.下列叙述正确的是( )
 如图装置所示,C、D、E、F、X、Y都是惰性电极,A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.下列叙述正确的是( )
如图装置所示,C、D、E、F、X、Y都是惰性电极,A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.下列叙述正确的是( )| A. | A是电源的负极 | |
| B. | 若C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为2:1:1:1 | |
| C. | 用丙装置给铜件镀银,则G应是铜件 | |
| D. | 丁中Y极附近的颜色逐渐变深,表明Fe(OH)3胶体胶粒带正电荷 |
16.下列说法正确的是( )
| A. | 葡萄糖与果糖、淀粉和纤维素分别为同分异构体 | |
| B. | 若某有机物在氧气中充分燃烧生成CO2和H2O物质的量相等,则该有机物是乙烯 | |
| C. | 燃烧乙烷、环丙烷(C3H6)混合气体,所产生的CO2的量一定小于燃烧相同质量的丙烯所产生的CO2 | |
| D. | 相同质量的乙烯和乙醇在氧气中充分燃烧,消耗的氧气相等 |
13.下列模型分别表示C2H2、S8、SF6的结构,下列说法错误的是( )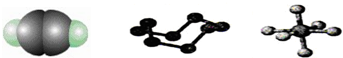

| A. | 32 g S8分子中含有0.125 mol σ键 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 1 mol C2H2分子中有3 mol σ键和2 mol π键 | |
| D. | 1 mol S8中含有8 mol S-S键 |
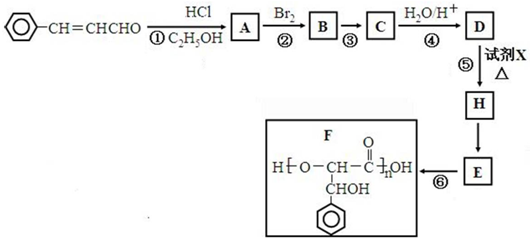
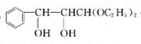 .
. +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$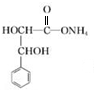 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.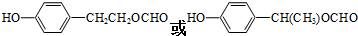 . (任写一种)
. (任写一种)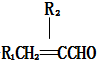
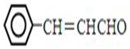 ,设计合成线路(其无机试剂任选),合成线路示意图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=$\stackrel{Br_{2}}{→}$CH2BrH2Br.
,设计合成线路(其无机试剂任选),合成线路示意图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=$\stackrel{Br_{2}}{→}$CH2BrH2Br.