题目内容
相同物质的量浓度的下列化合物的水溶液,按pH减小顺序排列的是
- A.Na2CO3 NH4Cl CH3COOH H2SO4
- B.Na2CO3 H2SO4 CH3COOH NH4Cl
- C.NH4Cl H2SO4 CH3COOH Na2CO3
- D.NH4Cl CH3COOH H2SO4 Na2CO3
A
试题分析:相同物质的量浓度,Na2CO3 由于碳酸根的水解而呈碱性,所以pH最大,NH4Cl 为强酸弱碱盐,水解呈酸性,pH小于7,而醋酸为弱酸,其水溶液呈酸性并且小于相同物质的量浓度的NH4Cl溶液,硫酸为强酸,所以其酸性最强,pH最小,所以相同物质的量浓度的下列化合物的水溶液,按pH减小顺序排列的是Na2CO3 NH4Cl CH3COOH H2SO4,故本题的答案选择A。
考点:盐类水解,酸
点评:本题考查了盐类水解,盐,该考点是高考考查的重点和难度,本题比较容易。
试题分析:相同物质的量浓度,Na2CO3 由于碳酸根的水解而呈碱性,所以pH最大,NH4Cl 为强酸弱碱盐,水解呈酸性,pH小于7,而醋酸为弱酸,其水溶液呈酸性并且小于相同物质的量浓度的NH4Cl溶液,硫酸为强酸,所以其酸性最强,pH最小,所以相同物质的量浓度的下列化合物的水溶液,按pH减小顺序排列的是Na2CO3 NH4Cl CH3COOH H2SO4,故本题的答案选择A。
考点:盐类水解,酸
点评:本题考查了盐类水解,盐,该考点是高考考查的重点和难度,本题比较容易。

练习册系列答案
相关题目
已知同温度、同物质的量浓度的NaX溶液的pH值大于NaY溶液的pH值,据此,下列对两种对应酸(HX和HY)在相同温度和浓度下的比较中正确的是( )
| A、c(X-)>c(Y-) | B、电离程度:HX>HY | C、HY溶液的pH值>HX溶液的pH | D、HY溶液中的c(H+)>HX溶液中的c(H+) |
中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是( )
| A、用沸点数据推测两种液体混合物用蒸馏方法分离开来的可能性 | B、用几种一元弱酸的电离常数Ka来比较相同温度下相同物质的量浓度的这几种一元弱酸的钠盐溶液的碱性强弱 | C、用几种相同类型的难溶电解质的Ksp来比较相同温度下它们的溶解度的大小 | D、用熔、沸点数据来分析分子的稳定性 |
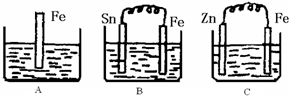
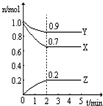
 2Z
2Z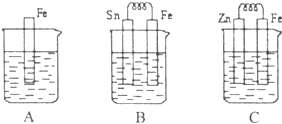 I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.