题目内容
20.为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气.下列关于Na2O2的叙述正确的是( )| A. | Na2O2能与酸反应生成盐和水,所以过氧化钠是碱性氧化物 | |
| B. | Na2O2中阴、阳离子的个数比为1:1 | |
| C. | Na2O2与CO2反应,每消耗1mol Na2O2,转移电子的物质的量为1mol | |
| D. | Na2O2的漂白原理与活性炭的漂白原理相同 |
分析 A.碱性氧化物是指:与酸反应只生成盐和水的氧化物;
B.过氧化钠中阴离子为过氧根离子;
C.过氧化钠与二氧化碳反应为歧化反应,过氧化钠即使氧化剂又是还原剂;
D.过氧化钠因为具有强的氧化性而具有漂白性,活性炭因为具有吸附性而具有漂白性.
解答 解:A.过氧化钠与盐酸反应产物除了生成盐和水外还有氧气,不属于碱性氧化物,故A错误;
B.过氧化钠中阴离子为过氧根离子,Na2O2中阴、阳离子的个数比为1:2,故B错误;
C.在 2Na2O2+2CO2═2Na2CO3+O2反应中,只有Na2O2中O元素的化合价发生变化,分别由-1价变化为0价和-2价,由2Na2O2+2CO2=2Na2CO3+O2~2e-可知,消耗1mol过氧化钠转移电子的物质的量为1mol,故C正确;
D.过氧化钠因为具有强的氧化性而具有漂白性,活性炭因为具有吸附性而具有漂白性,二者漂白原理不同,故D错误;
故选:C.
点评 本题考查了元素化合物知识,明确碱性氧化物概念、过氧化钠的性质是解题关键,题目难度不大,注意过氧化钠与水、二氧化碳、酸反应中过氧化钠既表现氧化性又表现还原性.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
10.下列说法中正确的是( )
| A. | 中子数为18的氯原子可表示为18Cl | |
| B. | 盐酸和食醋既是化合物又是酸 | |
| C. | 可以通过过滤的方法将淀粉胶体中混有的氯化钠溶液除去 | |
| D. | 6.8g熔融KHSO4与3.9g熔融Na2O2中阴离子数目相同 |
11.下列判断合理的是( )
①硫酸、烧碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③Na2O、Fe2O3、A12O3属于碱性氧化物
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥CO2、SO2、NO2,都能和碱溶液发生反应,因此它们都属于酸性氧化物.
①硫酸、烧碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③Na2O、Fe2O3、A12O3属于碱性氧化物
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥CO2、SO2、NO2,都能和碱溶液发生反应,因此它们都属于酸性氧化物.
| A. | 只有②④⑥ | B. | 只有①②⑤ | C. | 只有①③⑤ | D. | 只有③④⑥ |
15. 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )| A. | 电流由O2所在的铂电极流出 | |
| B. | 该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ | |
| C. | O2所在的铂电极处发生还原反应 | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
5.有关氧元素及含氧物质表示正确的是 ( )
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{10}$O | |
| B. | 氧离子(O2-)的结构示意图: | |
| C. | 某氧单质的球棍模型: | |
| D. | 某碳氧化合物电子式: |
10.恒温下,下列各组离子在指定溶液中-定能大量共存的是( )
| A. | 与铝反应产生氢气的溶液中:Na+、NH4+、SO42-、CH3C00- | |
| B. | c(Fe3+)=0.1mol•L-1的溶液中:NH4+、Cl-、AlO2-、SO42- | |
| C. | 使甲基橙变红的溶液中:K+、Al3+、SO42-、NO3- | |
| D. | 由水电离出的c(OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、I- |
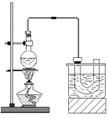 实验室制备溴乙烷(C2H5Br)的装置和步骤如下:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的∪形管和大烧杯中加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小心加热,使其充分反应.回答下列问题:
实验室制备溴乙烷(C2H5Br)的装置和步骤如下:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的∪形管和大烧杯中加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小心加热,使其充分反应.回答下列问题: