题目内容
16.可逆反应2SO2+O2?2SO3 达到一定限度后通入18O2,再经过一段时间,18O存在于( )| A. | SO2、O2中 | B. | SO3、SO2中 | C. | SO3中 | D. | SO3、SO2、O2中 |
分析 可逆反应中的两个化学反应,在相同条件下同时向相反方向进行,两个化学反应构成一个对立的统一体.根据质量守恒定律可知,反应前后的元素守恒,一段时间后的可逆反应体系中,每种物质都会存在18O.
解答 解:可逆反应一定是同一条件下能互相转换的反应,如二氧化硫、氧气在催化剂、加热的条件下,生成三氧化硫;而三氧化硫在同样的条件下可分解为二氧化硫和氧气.故18O2中的18O通过化合反应存在于SO3中,SO3 中的18O通过分解反应会存在于SO2中,最终SO3、SO2、O2中都含有18O.
故选D.
点评 本题考查可逆反应的可逆性.反应不能进行到底,可逆反应无论进行多长时间,反应物都不可能100%地全部转化为生成物.

练习册系列答案
相关题目
7.下列说法正确的是( )
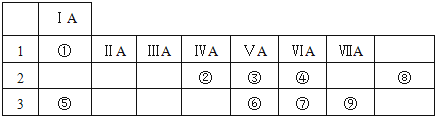
| A. | 第IA族元素的金属性比第IIA族元素的金属性强 | |
| B. | 原子最外层只有2个电子的元素一定是第ⅡA元素 | |
| C. | 碱金属的熔点和密度都是随着原子序数的增大而增大 | |
| D. | 如果发现了原子序数为117号元素,它应该属于金属元素 |
1.下列属于吸热反应的是( )
| A. | 镁的燃烧反应 | B. | 盐酸与氢氧化钠的反应 | ||
| C. | 水的分解反应 | D. | 铝与盐酸的反应 |
8.化学与我们人类生活息息相关,下列说法不正确的是( )
| A. | 合理使用化肥可以提高农作物的产量 | |
| B. | 生活中常使用热的纯碱溶液去除油污 | |
| C. | 明矾具有强氧化性,常用于自来水的杀菌消毒 | |
| D. | 船舶外壳装上锌块可以减缓其腐蚀 |
5.过氧化钙晶体CaO2•8H2O较稳定,呈白色,微溶于水,能溶于酸性溶液.广泛应用于环境杀菌、消毒等领域.过氧化钙晶体含量的测定(假定杂质不发生反应)
准确称取0.3000g产品于锥形瓶中,加入30mL蒸馏水和10mL 2.000mol•L-1 H2SO4,
发生化学反应:CaO2•8H2O+H2SO4═CaSO4+H2O2+8H2O用0.0200mol•L-1KMnO4
标准溶液滴定至终点.H2O2和KMnO4反应的离子方程式为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O重复上述操作两次.
(1)在滴定过程中,没有选用指示剂是因为高锰酸钾未过量前,溶液是无色的,当溶液变成浅红色.
(2)滴定终点观察到的现象为当滴入最后一滴KMnO4标准溶液后溶液由无色变浅红色,且30s不褪色.
(3)根据表中的数据,计算产品中CaO2•8H2O的质量分数(写出计算过程)
(4)用KMnO4溶液做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,若用放置了两周的KMnO4标准溶液去测定产品中CaO2•8H2O的质量分数,则测得的值将偏高(填“偏高”或“偏低”)
准确称取0.3000g产品于锥形瓶中,加入30mL蒸馏水和10mL 2.000mol•L-1 H2SO4,
发生化学反应:CaO2•8H2O+H2SO4═CaSO4+H2O2+8H2O用0.0200mol•L-1KMnO4
标准溶液滴定至终点.H2O2和KMnO4反应的离子方程式为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O重复上述操作两次.
(1)在滴定过程中,没有选用指示剂是因为高锰酸钾未过量前,溶液是无色的,当溶液变成浅红色.
(2)滴定终点观察到的现象为当滴入最后一滴KMnO4标准溶液后溶液由无色变浅红色,且30s不褪色.
(3)根据表中的数据,计算产品中CaO2•8H2O的质量分数(写出计算过程)
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 26.04 |
| 2 | 0.3000 | 2.00 | 25.02 |
| 3 | 0.3000 | 0.20 | 23.24 |
 .
. .
.
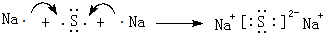 .
.