题目内容
常温下,A是可用来对自来水进行消毒的黄绿色气体单质.
(1)写出A与H2O反应的化学方程式: ;
(2)将气体A通入NaOH溶液反应的离子方程式为: ;
(3)将A的水溶液滴入含有酚酞的NaOH溶液中,红色褪去.试分析褪色可能的原因① ② ;
(4)在标准状况下,氢气和A的混合气体a L,经光照反应后混合气体恰好能与b mol的NaOH完全作用生成盐,则氢气的体积为 L(用含a、b的式子表示).
(1)写出A与H2O反应的化学方程式:
(2)将气体A通入NaOH溶液反应的离子方程式为:
(3)将A的水溶液滴入含有酚酞的NaOH溶液中,红色褪去.试分析褪色可能的原因①
(4)在标准状况下,氢气和A的混合气体a L,经光照反应后混合气体恰好能与b mol的NaOH完全作用生成盐,则氢气的体积为
考点:氯气的化学性质
专题:卤族元素
分析:常温下,A是可用来对自来水进行消毒的黄绿色气体单质,则A为C12,
(1)C12与水反应生成HCl、HClO;
(2)C12与NaOH反应生成NaCl、NaClO、水;
(3)可能为HClO的漂白性,可能为酸碱中和反应;
(4)恰好能与b mol的NaOH完全作用生成盐,则Na、Cl的物质的量比为1:1,以此计算.
(1)C12与水反应生成HCl、HClO;
(2)C12与NaOH反应生成NaCl、NaClO、水;
(3)可能为HClO的漂白性,可能为酸碱中和反应;
(4)恰好能与b mol的NaOH完全作用生成盐,则Na、Cl的物质的量比为1:1,以此计算.
解答:
解:常温下,A是可用来对自来水进行消毒的黄绿色气体单质,则A为C12,
(1)C12与水反应生成HCl、HClO,化学反应为C12+H2O=HCl+HClO,故答案为:C12+H2O=HCl+HClO;
(2)C12与NaOH反应生成NaCl、NaClO、水,离子反应为C12+2OH-=Cl-+ClO-+H2O,故答案为:C12+2OH-=Cl-+ClO-+H2O;
(3)A的水溶液滴入含有酚酞的NaOH溶液中,红色褪去,其原因可能为①氯水中的盐酸和次氯酸中和氢氧化钠(酸性),②氯水中的次氯酸的漂白作用(漂白性),
故答案为:氯水中的盐酸和次氯酸中和氢氧化钠;氯水中的次氯酸的漂白作用;
(4)恰好能与b mol的NaOH完全作用生成盐,则Na、Cl的物质的量比为1:1,n(C12)=0.5bmol,其标况下体积为0.5bmol×22.4L/mol=11.2bL,则氢气的体积为(a-11.2b)L,故答案为:a-11.2b.
(1)C12与水反应生成HCl、HClO,化学反应为C12+H2O=HCl+HClO,故答案为:C12+H2O=HCl+HClO;
(2)C12与NaOH反应生成NaCl、NaClO、水,离子反应为C12+2OH-=Cl-+ClO-+H2O,故答案为:C12+2OH-=Cl-+ClO-+H2O;
(3)A的水溶液滴入含有酚酞的NaOH溶液中,红色褪去,其原因可能为①氯水中的盐酸和次氯酸中和氢氧化钠(酸性),②氯水中的次氯酸的漂白作用(漂白性),
故答案为:氯水中的盐酸和次氯酸中和氢氧化钠;氯水中的次氯酸的漂白作用;
(4)恰好能与b mol的NaOH完全作用生成盐,则Na、Cl的物质的量比为1:1,n(C12)=0.5bmol,其标况下体积为0.5bmol×22.4L/mol=11.2bL,则氢气的体积为(a-11.2b)L,故答案为:a-11.2b.
点评:本题考查氯气的化学性质,为高频考点,把握物质的性质及发生的反应为解答的关键,注意(4)中利用盐中Na、Cl的物质的量关系计算,侧重分析能力和知识应用能力的考查,题目难度不大.

练习册系列答案
相关题目
下列反应属于非氧化还原反应的是( )
A、Fe2O3+3CO2
| ||||
B、NH4NO3
| ||||
C、2NaHCO3
| ||||
D、Cu2(OH)2CO3
|
 对于敞口容器中的反应:Zn(s)+H2SO4(aq)=ZnSO4 (aq)+H2(g),反应过程中能量关系可用右图表示,下列叙述中不正确的是( )
对于敞口容器中的反应:Zn(s)+H2SO4(aq)=ZnSO4 (aq)+H2(g),反应过程中能量关系可用右图表示,下列叙述中不正确的是( )| A、1 molZn的能量高于1 molH2的能量 |
| B、反应物Zn和H2SO4的总能量高于产物 ZnSO4和H2的总能量 |
| C、如果Zn足量,反应速率会经历由慢到快到慢的过程 |
| D、用锌粉代替锌粒,速率会加快 |
对于反应A(g)+3B(g)?2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
| A、v(A)=0.04 mol?L-1?s-1 |
| B、v(B)=0.03 mol?L-1?s-1 |
| C、v(C)=0.04 mol?L-1?s-1 |
| D、v(C)=0.06 mol?L-1?s-1 |
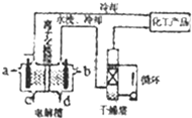 工业上电解饱和食盐水能制取多种化工原料,其设备示意图如图:
工业上电解饱和食盐水能制取多种化工原料,其设备示意图如图:

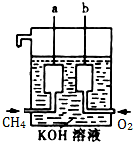 美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:
美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示: