题目内容
17.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH (g)(1)判断反应达到平衡状态的依据是(填字母序号,下同)CD.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c (CO)=0.2mol•L-1,则H2的转化率为53.3%,此时的温度为250℃,若在此温度下测得某时刻体系内各物质的浓度如下:c (CO)=0.5mol•L-1,c (H2)=0.2mol•L-1,c (CH3OH)=0.1mol•L-1,则此时该反应向逆方向进行(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”).
(3)要提高CO的转化率,可以采取的措施是DF.
A.升温 B.加入催化剂 C.增加CO的浓度
D.加入H2 E.加入惰性气体 F.分离出甲醇.
分析 (1)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(2)①由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应;
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c (CO)=0.2mol•L-1,则:
CO(g)+2H2(g)?CH3OH (g)
起始浓度(mol/L):1 3 0
变化浓度(mol/L):0.8 1.6 0.8
平衡浓度(mol/L):0.2 1.4 0.8
转化率=$\frac{浓度变化量}{起始浓度}$×100%,根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数,进而确定温度;
计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行;
(3)A.正反应为放热反应,升高温度,平衡逆向移动;
B.加入催化剂不影响平衡移动;
C.增加CO的浓度,CO的转化率降低;
D.加入H2平衡正向移动;
E.恒温恒容下,加入惰性气体,各组分浓度不变,平衡不移动;
F.分离出甲醇,平衡正向移动.
解答 解:(1)A.生成CH3OH的速率与消耗CO的速率相等,均表示正反应速率,反应始终按该比例关系进行,故A错误;
B.混合气体总质量不变,容器容积不变,混合气体的密度始终不变,故B错误;
C.混合气体总质量不变,随反应进行混合气体物质的量变化,则平均相对分子质量变化,若平均相对平均分子质量不变,说明到达平衡,故C正确;
D.CH3OH、CO、H2的浓度都不再发生变化,说明到达平衡,故D正确,
故选:CD;
(2)①由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应,则△H<0,故答案为:<;
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c (CO)=0.2mol•L-1,则:
CO(g)+2H2(g)?CH3OH (g)
起始浓度(mol/L):1 3 0
变化浓度(mol/L):0.8 1.6 0.8
平衡浓度(mol/L):0.2 1.4 0.8
氢气转化率=$\frac{1.6mol/L}{3mol/L}$×100%=53.3%;
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.8}{0.2×1.{4}^{2}}$=2.041,故温度为250℃;
浓度商Qc=$\frac{0.1}{0.5×0.{2}^{2}}$=5>K=2.041,反应向逆反应进行,
故答案为:53.3%;250℃;向逆方向进行;
(3)A.正反应为放热反应,升高温度,平衡逆向移动,CO的转化率减小,故A错误;
B.加入催化剂不影响平衡移动,CO的转化率不变,故B错误;
C.增加CO的浓度,CO的转化率降低,故C错误;
D.加入H2平衡正向移动,CO的转化率增大,故D正确;
E.若恒温恒容下,加入惰性气体,各组分浓度不变,平衡不移动,CO的转化率不变,故E错误;
F.分离出甲醇,平衡正向移动,CO的转化率增大,故F正确,
故选:DF.
点评 本题考查化学平衡计算及影响因素、平衡状态判断、平衡常数应用等,注意理解根据浓度商与平衡常数相对大小判断反应进行方向,难度中等.

 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
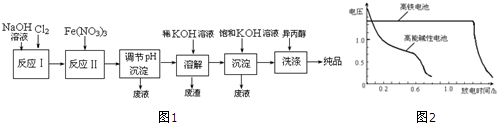
优加精卷系列答案| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
①实验室制备Cl2的化学方程式为MnO2+4HCl(浓盐酸)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
②反应I的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O.
③湿法制备高铁酸盐的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,产生的Fe(OH)3胶体有吸附性,能吸附水中悬浮物质形成沉淀,从而净化水.
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为3:1.
(4)高铁电池是可充电电池,其反应为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.其正极的电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-阴极的电极反应式为Zn(OH)2+2e-=Zn+2OH-
如图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长,工作电压稳定.
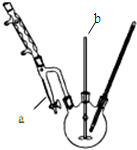
请根据实验步骤,回答下列问题:(已知:NaBr+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr)

(1)关闭K1和K2,接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.竖直冷凝管的作用 是冷凝回流,使冷水从a(填a或b)处流入.
(2)写出A中发生反应的主要化学方程式:NaBr+H2SO4═HBr+NaHSO4、HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢、硫酸氢钠、水等.熄灭A处酒 精灯,在竖直冷凝管上方塞上塞子、打开K1,利用余热继续反应直至冷却,通过C、D装置检验
部分副产物,C、D中应盛放的试剂分别是硝酸银、高锰酸钾溶液或溴水,
观察到D瓶中的现象是溶液褪色
(4)相关有机物的数据如下:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |

(1)配制30%BaS溶液,现有量筒、烧杯及玻璃棒,还缺少的实验仪器有托盘天平.
(2)加入锌粉被还原的离子有Fe3+、Cu2+.
(3)在弱酸性条件下,KMnO4除Mn2+时发生的离子反应是2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(4)若所得ZnSO4酸性较强,可采取的简单措施是加少量的锌粉,搅拌直到溶解.
(5)两种溶液合成立德粉,还需要经过陈化、过滤、洗涤、干燥、焙烧、磨粉得成品.
(6)若最后发现立德粉成品白度不够,其可能原因是Cu2+、Mn2+及Fe3+没有除尽.
(7)某研究性学习小组欲从废电池锌片 (主要成分为Zn、Fe、C)出发,先制备纯净的硫酸锌溶液,再合成立德粉.请补充完整由废锌片制备ZnSO4溶液的实验步骤[如表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)].
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验步骤依次为:
①用稍过量3.0 mol•L-1 H2SO4溶解废锌皮;
②加入适量30% H2O2,使其充分反应;
③1.0 mol•L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
④过滤得滤液.
| A. | 1mol H2O中含有的原子数为NA | |
| B. | 2g H2中含有的氢原子数为2NA | |
| C. | 常温常压下,11.2L N2中含有的分子数为0.5N A | |
| D. | 1L 0.1 mol/L NaNO3溶液中含有的钠离子数为NA |


 塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂.反应原理为:
塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂.反应原理为: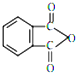 +2CH3CH2CH2CH2OH→
+2CH3CH2CH2CH2OH→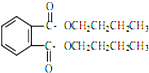 +H2O
+H2O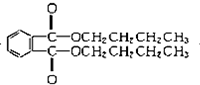 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$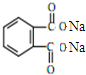 +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.