题目内容
17.下列关于氯气的叙述正确的是( )| A. | 氯气是一种黄绿色、有毒的气体 | |
| B. | 氯气在自然界中既有化合态,也有游离态 | |
| C. | 氯气不能溶于水,可以用排水法收集氯气 | |
| D. | 铁在足量氯气中燃烧生成氯化亚铁 |
分析 A.根据氯气是有颜色和刺激性气味的气体进行解答;
B.根据氯气具有强氧化性判断;
C.根据氯气能溶于水,并与水能发生反应进行解答;
D.根据氯气具有强氧化性进行解答.
解答 解:A.氯气是一种黄绿色、有刺激性气味、有毒的气体,故A正确;
B.氯气具有强氧化性,所以在自然界中只有化合态,没有游离态,故B错误;
C.氯气能溶于水,并与水能发生反应,所以不能用排水法收集氯气,故C错误;
D.氯气具有强氧化性,则铁在足量氯气中燃烧生成氯化铁,故D错误.
故选:A.
点评 本题考查氯气的性质,难度不大,注意具有强氧化性,与变价金属反应生成最高价.

练习册系列答案
相关题目
8.一种海水电池的反应原理可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,有关反应的说法正确的是
( )
( )
| A. | 反应中MnO2是还原剂 | |
| B. | 电池工作时,海水起导电作用,其中NaCl浓度保持不变 | |
| C. | Ag为负极,电极反应为Ag-e-+Cl-=AgCl | |
| D. | 每生成1 mol Na2Mn5Ol0转移1mol电子 |
5.关于化学键的各种叙述中正确的是( )
| A. | 离子化合物里一定不存在共价键 | |
| B. | 共价化合物里一定不存在离子键 | |
| C. | 非极性键只存在于双原子的单质分子里 | |
| D. | 由不同元素组成的多原子分子里,一定只存在极性键 |
12.金属晶体的下列性质中,不能用金属晶体结构加以解释的是( )
| A. | 易导电 | B. | 易导热 | C. | 有延展性 | D. | 易锈蚀 |
2.下列物质中,既含离子键又含共价键的是( )
| A. | KCl | B. | NaOH | C. | CCl4 | D. | H2O |
9.化学与材料、生活和环境密切相关.下列有关说法中正确的是( )
| A. | 煤炭经蒸馏、气化和液化等过程,可获得清洁能源和重要的化工原料 | |
| B. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 | |
| C. | “海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子化合物 |
6.下面是用硫酸钙生产硫酸、漂白粉等一系列物质的流程图.下列说法正确的是( )

| A. | CO、SO2、SO3均是酸性氧化物 | |
| B. | 图示转化反应均为氧化还原反应 | |
| C. | 工业上用氯气和石灰乳制取漂白粉的反应中原子利用率为100% | |
| D. | 严禁用工业酒精勾兑饮用酒是因为工业酒精中含有有毒的甲醇 |
18. (1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
(1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1
已知:CO燃烧热△H2=-283kj/mol
N2(g)+O2(g)=2NO(g)△H3
几种化学键的键能数据如表一:
表一:
上述△H3=+183kJ•moL-1,△H1=-749kJ•moL-1.
(2)NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划.在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行下述反应I,测得不同时间的NH3和O2的浓度如表:
表二:
则下列有关叙述中正确的是AD
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4υ正(NH3)=6υ逆(H2O)时,说明反应已达平衡
C.当容器内$\frac{n(NO)}{n(N{H}_{3})}$=1时,说明反应已达平衡
D.前10分钟内的平均速率υ(NO)=0.088mol•L-1•min-1
(3)氨催化氧化时会发生下述两个竞争反应I、II.催化剂常具有较强的选择性,即专一性.已知:反应I:4NH3(g)+5O2(g)$?_{高温}^{Pt/Ru}$ 4NO(g)+6H2O(g)
反应II:4NH3(g)+3O2(g)$?_{高温}^{Cu/TiO_{2}}$ 2N2(g)+6H2O(g)
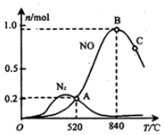
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1mol NH3和2mol O2,测得有关物质的量关系如图:
①该催化剂在高温时选择反应I(填“I”或“II”).
②520℃时,4NH3+3O2?2N2+6H2O的平衡常数K=$\frac{0.{2}^{4}×0.{9}^{6}}{0.{4}^{4}×1.4{5}^{5}}$(不要求得出计算结果,只需列出数字计算式).
③由图象可判断,反应I正反应△H<0(填“>”、“<”或“=”)
④C点比B点所产生的NO的物质的量少的主要原因升高温度平衡逆向移动.
(4)羟胺(NH2OH)的电子式 ,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
 (1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
(1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1
已知:CO燃烧热△H2=-283kj/mol
N2(g)+O2(g)=2NO(g)△H3
几种化学键的键能数据如表一:
表一:
| 化学键 | N≡N | O=O | NO中氮氧键 |
| 键能(kJ/mol) | 945 | 498 | 630 |
(2)NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划.在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行下述反应I,测得不同时间的NH3和O2的浓度如表:
表二:
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| c(NH3)/mol•L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.0072 | 0.0072 |
| c(O2)/mol•L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4υ正(NH3)=6υ逆(H2O)时,说明反应已达平衡
C.当容器内$\frac{n(NO)}{n(N{H}_{3})}$=1时,说明反应已达平衡
D.前10分钟内的平均速率υ(NO)=0.088mol•L-1•min-1
(3)氨催化氧化时会发生下述两个竞争反应I、II.催化剂常具有较强的选择性,即专一性.已知:反应I:4NH3(g)+5O2(g)$?_{高温}^{Pt/Ru}$ 4NO(g)+6H2O(g)
反应II:4NH3(g)+3O2(g)$?_{高温}^{Cu/TiO_{2}}$ 2N2(g)+6H2O(g)
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1mol NH3和2mol O2,测得有关物质的量关系如图:
①该催化剂在高温时选择反应I(填“I”或“II”).
②520℃时,4NH3+3O2?2N2+6H2O的平衡常数K=$\frac{0.{2}^{4}×0.{9}^{6}}{0.{4}^{4}×1.4{5}^{5}}$(不要求得出计算结果,只需列出数字计算式).
③由图象可判断,反应I正反应△H<0(填“>”、“<”或“=”)
④C点比B点所产生的NO的物质的量少的主要原因升高温度平衡逆向移动.
(4)羟胺(NH2OH)的电子式
 ,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.