题目内容
16.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )| A. | H2O ( g )═H2 ( g )+$\frac{1}{2}$O2 ( g )△H=+242 kJ/mol | |
| B. | 2H2 ( g )+O2( g )═2H2O ( l )△H=-484 kJ/mol | |
| C. | H2 ( g )+$\frac{1}{2}$O2 ( g )═H2O (g )△H=+242 kJ/mol | |
| D. | 2H2 ( g )+O2 ( g )═2H2O ( g )△H=+484 kJ/mol |
分析 2mol氢气燃烧生成水蒸气放出484kJ热量,则1mol氢气燃烧生成水蒸气放出242kJ热量,逆过程就要吸收这些热量,据此回答.
解答 解:2mol氢气燃烧生成水蒸气放出484kJ热量,则1mol氢气燃烧生成水蒸气放出242kJ热量,H2 ( g )+$\frac{1}{2}$O2 ( g )=H2O ( g )△H=-242 kJ/mol,2H2 ( g )+O2 ( g )=2H2O ( g )△H=-484kJ/mol,故CD错误,逆过程就要吸收这些热量,有:H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+242kJ•mol-1,故A正确,B错误;
故选A.
点评 本题主要考查学生热化学方程式的书写原则,该题型是现在高考的热点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法表示更便于理解.下列表达正确的是( )
| A. | Na2CO3溶液和盐酸反应后溶液中的钠盐: | |
| B. | NaOH溶液与CO2反应后溶液中的钠盐: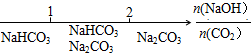 | |
| C. | Fe与稀硝酸反应的氧化产物: | |
| D. | AlCl3溶液中滴加氨水后铝元素的存在形式: |
8.向下列溶液中滴加稀H2S04,一开始出现白色沉淀,继续滴加稀H2S04,沉淀又溶解的是( )
| A. | AlCl3 | B. | NaAl02 | C. | Mgcl2 | D. | BaCl2 |
4.研究氮的固定具有重要意义.
(1)雷雨天气中发生自然固氮后,氮元素转化为硝酸盐而存在于土壤中.处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H K ①
已知:N2(g)+3H2(g)=2NH3(g)△H1=-92.4kJ•mol-1 K1②
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1 K2③
则△H=+1530kJ•mol-1;K=$\frac{{{K}_{1}}^{2}}{{{K}_{2}}^{3}}$(用K1和 K2表示).
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3小时,实验数据见下表:
下列能说明反应①达到平衡状态的是bd(填字母).
a.NH3和O2的物质的量之比为4:3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为3×10-4%;与前三组相比,第四组反应中NH3生成量最小的原因可能是催化剂在80℃活性减小,反应速率反而减慢.
(1)雷雨天气中发生自然固氮后,氮元素转化为硝酸盐而存在于土壤中.处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H K ①
已知:N2(g)+3H2(g)=2NH3(g)△H1=-92.4kJ•mol-1 K1②
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1 K2③
则△H=+1530kJ•mol-1;K=$\frac{{{K}_{1}}^{2}}{{{K}_{2}}^{3}}$(用K1和 K2表示).
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3小时,实验数据见下表:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
a.NH3和O2的物质的量之比为4:3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为3×10-4%;与前三组相比,第四组反应中NH3生成量最小的原因可能是催化剂在80℃活性减小,反应速率反而减慢.
1. 50mL 0.5mol•L-1盐酸和50mL 0.55mol•L-1的烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,试回答下列问题:
50mL 0.5mol•L-1盐酸和50mL 0.55mol•L-1的烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,试回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是温度计.
(2)他们记录的实验数据如表中所示.已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18J•℃-1•g-1,各物质的密度均为1g•cm-3.则中和热△H=-55.2kJ/mol(取小数点后1位);根据实验结果用离子方程式表示上述反应中和热的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-55.2kJ/mol.
(3)下列说法正确的是C(填字母).
A.所有酸、碱稀溶液反应的中和热相等
B.准确测定中和热的实验中,至少需测定温度4次
C.烧杯之间用纸屑填充的目的是为了避免实验测定的△H偏高
D.若改用60mL 0.5mol•L-1盐酸和50mL 0.55mol•L-1的烧碱溶液进行上述反应,从理论上说,放出的热量相等.
 50mL 0.5mol•L-1盐酸和50mL 0.55mol•L-1的烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,试回答下列问题:
50mL 0.5mol•L-1盐酸和50mL 0.55mol•L-1的烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,试回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是温度计.
(2)他们记录的实验数据如表中所示.已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18J•℃-1•g-1,各物质的密度均为1g•cm-3.则中和热△H=-55.2kJ/mol(取小数点后1位);根据实验结果用离子方程式表示上述反应中和热的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-55.2kJ/mol.
| 实验 序号 | 起始温度 平均值t1 | 终止温度 t2 |
| 1 | 20℃ | 23.2℃ |
| 2 | 20℃ | 23.4℃ |
A.所有酸、碱稀溶液反应的中和热相等
B.准确测定中和热的实验中,至少需测定温度4次
C.烧杯之间用纸屑填充的目的是为了避免实验测定的△H偏高
D.若改用60mL 0.5mol•L-1盐酸和50mL 0.55mol•L-1的烧碱溶液进行上述反应,从理论上说,放出的热量相等.
8.在浓盐酸中HNO2与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2HNO2+6H+═N2↑+3SnCl${\;}_{x}^{y-}$+4H2O关于该反应的说法中正确的组合是( )
①氧化剂是HNO2
②还原性:Cl->N2
③每生成2.8g N2,还原剂失去的电子为0.6mol
④x为4,y为2
⑤SnCl${\;}_{x}^{y-}$是氧化产物.
①氧化剂是HNO2
②还原性:Cl->N2
③每生成2.8g N2,还原剂失去的电子为0.6mol
④x为4,y为2
⑤SnCl${\;}_{x}^{y-}$是氧化产物.
| A. | ①③⑤ | B. | ①②④⑤ | C. | ①②③④ | D. | 只有①③ |
6.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH${\;}_{4}^{+}$、Cl-、Mg2+、Ba2+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$,现取三份溶液各100mL进行如下实验:
(1)第一份加入AgNO2溶液有沉淀产生.
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol.
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.63g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.(已知NH${\;}_{4}^{+}$与OH-的反应为NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O)根据上述实验,以下推测中不正确的是( )
(1)第一份加入AgNO2溶液有沉淀产生.
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol.
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.63g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.(已知NH${\;}_{4}^{+}$与OH-的反应为NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O)根据上述实验,以下推测中不正确的是( )
| A. | 100mL溶液中一定只有0.02molK+ | B. | 溶液中CO${\;}_{3}^{2-}$浓度为0.1mol/L | ||
| C. | 不能确定Cl-是否存在 | D. | Ba2+和Mg2+一定不存在 |