题目内容
【题目】甲醇燃料电池被认为是21世纪电动汽车候选动力源
(1)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H1=+49.0kJmol﹣1
②CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2(g)△H2
O2(g)═CO2(g)+2H2(g)△H2
已知H2(g)+ ![]() O2(g)═H2O(g)△H=﹣241.8kJmol﹣1 , 则反应②的△H2= .
O2(g)═H2O(g)△H=﹣241.8kJmol﹣1 , 则反应②的△H2= .
(2)工业上一般可采用如图1所示反应来合成甲醇:CO(g)+2H2(g)CH3OH(g),现实验室模拟该反应并进行分析,图1是该反应在不同温度下CO的转化率随时间变化的曲线
①该反应的焓变△H0(填“>”“<”或“=”).
②T1和T2温度下的平衡常数大小关系是K1K2(填“>”“<”或“=”)
③现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2 , 测得CO 和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,CO的平均反应速率v(CO)= , 该反应的平衡常数为K=![]()
④恒容条件下,达到平衡后,下列措施中能使 ![]() 增大的有
增大的有
A.升高温度 B.充入He(g)
C.再充入1molCO 和3molH2 D.使用催化剂.
【答案】
(1)﹣192.8kJ?mol﹣1
(2)<,>,0.225mol/(L?min),![]() ,C
,C
【解析】解:(1)由盖斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJmol﹣1、③H2(g)+ ![]() O2(g)═H2O(g)△H=﹣241.8kJmol﹣1,①+③得到反应②,则△H2=+49.0kJmol﹣1+(﹣241.8kJmol﹣1)=﹣192.8kJmol﹣1;
O2(g)═H2O(g)△H=﹣241.8kJmol﹣1,①+③得到反应②,则△H2=+49.0kJmol﹣1+(﹣241.8kJmol﹣1)=﹣192.8kJmol﹣1;
(2)①根据先拐先平原则,由图1可知,温度T1<T2,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应;
②平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应;升高温度,平衡向逆反应移动,所以K1>K2;
③由图2可知,10min达平衡时甲醇的浓度变化量为0.75mol/L,所以v(CH3OH)= ![]() =0.075mol/(Lmin),速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.075mol/(Lmin)=0.225mol/(Lmin);
=0.075mol/(Lmin),速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.075mol/(Lmin)=0.225mol/(Lmin);
平衡时c(CH3OH)=c(H2O)=0.75mol/L,c(CO2)=0.25mol/L,反应消耗二氧化碳浓度为0.75mol/L,则反应消耗氢气浓度为0.75mol/L×3=2.25mol/L,则达到平衡时氢气浓度为:c(H2)=3mol/L﹣2.25mol/L=0.75mol/L,所以该温度下该反应的平衡常数K= ![]() =
= ![]() ;
;
④要使 ![]() 增大,应使平衡向正反应方向移动
增大,应使平衡向正反应方向移动
A.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则n(CH3OH)/n(CO2)增大,故C正确;
D.使用催化剂,平衡不移动,故n(CO)和n(CH3OH)均不变,故D错误;
所以答案是:(1)﹣192.8kJmol﹣1;(2)①<;②>;③0.225mol/(Lmin);![]() ;④C
;④C
【考点精析】掌握化学平衡状态本质及特征和化学平衡的计算是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

【题目】某工厂排出的铬渣含有SiO2、A12O3、Fe2O3、Na2Cr2O7(易溶于水,是强氧化剂)等,处理建议是将+6价铬转化为低毒性的+3价铬后制备K2Cr2O7。实验室模拟处理铬渣的工艺流程如下(部分操作和条件略):

(1)已知过滤1后的滤液中存在如下平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+,则滤液应呈现的颜色是_________
2CrO42-(黄色)+2H+,则滤液应呈现的颜色是_________
(2)滤渣1的成分为______ 滤渣2中所含的金属元素为___________
(3)根据表中生成成氧化物沉淀的pH数据判断,流程中a的范围为__________。
物质 | Fe(OH)3 | Al(OH)3 | Cr(OH)3 | Fe(OH)2 |
开始沉淀 | 1.5 | 3.4 | 4.9 | 6.3 |
完全沉淀 | 2.8 | 4.7 | 5.5 | 8.3 |
(4)过滤3所得滤液又回流到过滤1所得滤液中,其目的是__________
(5)由Cr(OH)3得到黄色溶液过程中发生的反应的离子方程式是_________
(6)向橙色的K2Cr2O7溶液中,滴加Ba(NO3)2溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是_________,用平衡移动的原理解释溶液pH变小的原因是________.
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣5molL﹣1 | K1=4.4×10﹣7molL﹣1 | 3.0×10﹣8 |
请回答下列问题:
(1)同浓度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为 .
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是(填字母序号,下同).
A.c(H+) B. ![]() C.c(H+)c(OH﹣)
C.c(H+)c(OH﹣)
D. ![]() E.
E. ![]()
若该溶液升高温度,上述5种表达式的数据增大的是 .
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图: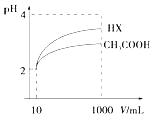
则HX的电离平衡常数(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中由水电离出来的c(H+)(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是 .
(4)已知100℃时,水的离子积为1×10﹣12 , 该温度下测得某溶液pH=7,该溶液显(填“酸”、“碱”或“中”)性.将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b= .


