题目内容
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣5molL﹣1 | K1=4.4×10﹣7molL﹣1 | 3.0×10﹣8 |
请回答下列问题:
(1)同浓度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为 .
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是(填字母序号,下同).
A.c(H+) B. ![]() C.c(H+)c(OH﹣)
C.c(H+)c(OH﹣)
D. ![]() E.
E. ![]()
若该溶液升高温度,上述5种表达式的数据增大的是 .
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图: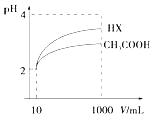
则HX的电离平衡常数(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中由水电离出来的c(H+)(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是 .
(4)已知100℃时,水的离子积为1×10﹣12 , 该温度下测得某溶液pH=7,该溶液显(填“酸”、“碱”或“中”)性.将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b= .
【答案】
(1)CO32﹣>ClO﹣>HCO3﹣>CH3COO﹣
(2)A,ABCE
(3)大于,大于,HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱
(4)碱,11:9
【解析】解:(1)平衡常数越大,则其结合氢离子能力越弱,由于电离平衡常数CH3COOH>H2CO3>HCO3﹣>HClO,则同浓度CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为:CO32﹣>ClO﹣>HCO3﹣>CH3COO﹣;
(2)A.0.1molL﹣1的CH3COOH溶液加稀释过程中,溶液中氢离子浓度减小,故A正确;
B.0.1molL﹣1的CH3COOH溶液加稀释过程中,各个微粒浓度减小,同时醋酸的电离向右移动,c(H+)减小的程度小于c(CH3COOH)的减小程度,则 ![]() 增大,故B错误;
增大,故B错误;
C.Kw=c(H+)c(OH﹣)只受温度的影响,温度不变则其值是一个常数,故C错误;
D.醋酸稀释,酸性减弱,c(H+)减小,水的离子积不变,则c(OH﹣)增大,所以 ![]() 增大,故D错误;
增大,故D错误;
E. ![]() 为醋酸的电离平衡常数,由于温度不变,则水的电离平衡常数不变,故E错误;故选A,
为醋酸的电离平衡常数,由于温度不变,则水的电离平衡常数不变,故E错误;故选A,
若该溶液升高温度,醋酸、水的电离程度对增大,则溶液中氢离子、氢氧根离子浓度都增大,
A.升高温度后溶液中氢离子浓度c(H+)增大,故A正确;
B.升高温度后氢离子、氢氧根离子浓度都增大,醋酸的浓度减小,则 ![]() 的比值增大,故B正确;
的比值增大,故B正确;
C.c(H+)c(OH﹣)为水的离子积,升高温度后水的电离程度增大,则水的离子积增大,故C正确;
D.升高温度后氢氧根离子、氢离子浓度都增大,但氢氧根离子浓度增大的幅度大于氢氧根离子,所以 ![]() 的比值减小,故D错误;
的比值减小,故D错误;
E. ![]() 为醋酸的电离平衡常数,升高温度后产生的电离平衡常数增大,故E正确;故选ABCE,
为醋酸的电离平衡常数,升高温度后产生的电离平衡常数增大,故E正确;故选ABCE,
(3)根据图象分析知道,起始是两种溶液中c(H+)相同,c(较弱酸)>c(较强酸),稀释过程中较弱酸的电离程度增大,故在整个稀释过程中较弱酸的c(H+)一直大于较强酸的c(H+),稀释相同倍数,HX的pH变化比CH3COOH的大,故HX酸性强,电离平衡常数大;HX酸性强于CH3COOH的,稀释后HX溶液中c(H+)小于CH3COOH溶液中的c(H+),所以对水的抑制能力减弱;
(4)100℃时,水的离子积为1×10﹣12,c(H+)=10﹣6mol/L,pH=6,为中性溶液,该温度下测得某溶液pH=7,该溶液显碱性,将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2说明溶液显酸性,c(H+)=  =10﹣2mol/L,
=10﹣2mol/L,
a:b=11:9;
所以答案是:(1)CO32﹣>ClO﹣>HCO3﹣>CH3COO﹣;(2)A;ABCE;(3)大于;大于;HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱.(4)碱; 11:9;
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案






