题目内容
3.根据下列原电池的装置图,回答问题:
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为2H++2e-═H2↑;反应进行一段时间后溶液C的pH将升高(填“升高”“降低”或“基本不变”).
(2)若需将反应:Cu+2Fe3+═Cu2++2Fe2+设计成如图1所示的原电池装置,则:负极A极材料为Cu,正极B极材料为石墨(或比铜活泼性弱的金属),溶液C为FeCl3溶液.
(3)用CH4和O2组合形成的质子交换膜燃料电池的结构示意图2如图:
①则d电极是正(填“正极”或“负极”),c电极的反应方程式为:CH4-8e-+2H2O═CO2+8H+.
②若线路中转移2mol电子,则上述燃料电池,消耗的O2在标况下的体积为11.2L.
分析 (1)铁作负极,原电池反应是铁与稀硫酸置换氢气的反应,正极反应是氢离子得电子生成氢气,负极上是金属铁失电子,据此回答;
(2)根据方程式中物质发生的反应类型判断,Cu发生氧化反应,作负极,B极材料是比Cu不活泼的导电物质,溶液C中含有Fe3+;
(3)①原电池中电子从负极经外电路流向正极,负极反应氧化反应,结合电解质书写电极反应式;
②根据关系式O2~4e-来计算.
解答 解:(1)铁作负极,则该原电池反应是铁与稀硫酸置换氢气的反应,所以正极反应是氢离子得电子生成氢气,电极反应式为2H++2e-═H2↑;溶液中氢离子放电,导致溶液中氢离子浓度减小,pH升高,
故答案为:2H++2e-═H2↑;升高;
(2)Cu+2Fe3+=Cu2++2Fe2+设计成如上图所示的原电池装置,根据方程式中物质发生的反应类型判断,Cu发生氧化反应,作原电池的负极,所以A材料是Cu,B极材料是比Cu不活泼的导电物质如石墨、Ag等即可.溶液C中含有Fe3+,如FeCl3溶液,
故答案为:Cu; 石墨(或比铜活泼性弱的金属);FeCl3溶液;
(3)①因c是电子流出的一极,则c为负极,d为正极,甲烷具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CH4-8e-+2H2O═CO2+8H+,
故答案为:正;CH4-8e-+2H2O═CO2+8H+;
②原电池中正极电极反应为2O2+8H++8e-═4H2O,当转移2mol电子时,则生成氧气物质的量为0.5mol,体积为0.5mol×22.4L/mol=11.2L;
故答案为:11.2.
点评 本题考查对原电池反应原理的应用、电极的判断、电解质溶液的选择、电极反应式的书写等知识,属于综合知识的考查,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | H2O2既是氧化剂又是还原剂 | |
| B. | FeCl3对H2O2的分解起催化作用 | |
| C. | 使用FeCl2代替FeCl3,不能起到催化作用 | |
| D. | 反应过程中有Fe2+生成 |
| A. | 水电离产生的c(H+)=1×10-13mol/L的溶液中:K+、Ba2+、Cl-、NO3- | |
| B. | 使紫色石蕊试液变红的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 在酸性高锰酸钾溶液中:Na+、NH4+、I-、ClO- | |
| D. | 在FeCl3溶液中:K+、Na+、SO42-、AlO2- |
用如图装置进行实验,甲逐滴加入到固体乙中,如表说法正确的是( )
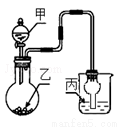
选项 | 液体甲 | 固体乙 | 溶液丙 | 丙中现象 |
A |
| NaHCO3 | 苯酚钠 |
|
B | 浓HCl | KMnO4 | 紫色石蕊 | 最终呈红色 |
C | 浓H2SO4 | Na2SO3 | 品红 | 红色变无色 |
D | 浓H2SO4 | Cu | 氢硫酸 | 溶液变浑浊 |
A.A B.B C.C D.D
D.D
 A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B、D同周期,C、D同主族,A的原子结构示意图如图,B、C可形成离子化合物B2C2或B2C据此填空:
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B、D同周期,C、D同主族,A的原子结构示意图如图,B、C可形成离子化合物B2C2或B2C据此填空:
 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 CH3COOH
CH3COOH