题目内容
11.图表法、图象法是常用的科学研究方法.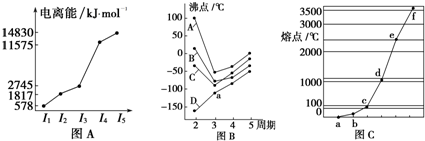
(1)图A是研究短周期某主族元素M的电离能变化情况的图象.则M元素位于元素周期表的第ⅢA族.
(2)图B是研究部分元素氢化物的沸点变化规律的图象,每条折线表示元素周期表ⅣA~ⅦA族中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的氢化物的分子式为H2S,A、B、C折线中第二周期元素的气态氢化物的沸点显然高于第三周期元素气态氢化物的沸点,其原因是NH3、H2O、HF因在分子间存在氢键,强度远远大于分子间作用力,故沸点高于同主族其它元素氢化物的沸点.
(3)图C是研究Na、Cu、Si、H、C、N等元素单质的熔点高低顺序的图象,其中c、d均是热和电的良导体.单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含有2个σ键和2个π键.
分析 (1)根据图A可知,M元素的第四电离能剧增,说明M原子易失去三个电子,最外层电子数为3;
(2)在ⅣA~ⅦA中的氢化物里,由于N、O、F电负性大,NH3、H2O、HF因在分子间存在多条结合力较大的氢键,总强度远远大于分子间作用力,故沸点高于同主族其它元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象,a为第三周期ⅣA族元素氢化物;
(3)Na、Cu、Si、H、C、N等元素单质中,Na、Cu为金属晶体,均是热和电的良导体,Cu沸点高于NA,C、Si的单质为原子晶体,且C单质的熔沸点大于Si原子晶体的熔沸点,H、N对应的单质为分子晶体,其中氢气的熔点最低,由图熔点的高低顺序可知,a为H,b为N,c为Na,d为Cu,e为Si,f为C,a、b、f对应的元素以原子个数比1:1:1形成的分子为HCN,结构式为H-C≡N.
解答 解:(1)根据图A可知,M元素的第四电离能剧增,说明M原子易失去三个电子,最外层电子数为3,故为第ⅢA族元素,故答案为:ⅢA族;
(2)在ⅣA~ⅦA中的氢化物里,由于N、O、F电负性大,NH3、H2O、HF因在分子间存在氢键,强度远远大于分子间作用力,故沸点高于同主族其它元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象,a为第三周期ⅣA族元素氢化物H2S,
故答案为:H2S;NH3、H2O、HF因在分子间存在氢键,强度远远大于分子间作用力,故沸点高于同主族其它元素氢化物的沸点;
(3)Na、Cu、Si、H、C、N等元素单质中,Na、Cu为金属晶体,均是热和电的良导体,Cu沸点高于NA,C、Si的单质为原子晶体,且C单质的熔沸点大于Si原子晶体的熔沸点,H、N对应的单质为分子晶体,其中氢气的熔点最低,由图熔点的高低顺序可知,a为H,b为N,c为Na,d为Cu,e为Si,f为C,a、b、f对应的元素以原子个数比1:1:1形成的分子为HCN,结构式为H-C≡N,分子中含2个σ键,2个π键,
故答案为:2;2.
点评 本题是对物质结构的考查,涉及电离能、氢键、熔沸点比较、化学键等,根据图示推出各对应元素是解答关键,需要学生具备扎实的基础,题目难度中等.

| A. | 浓硝酸常显黄色的原因是浓硝酸中溶有少量NO2 | |
| B. | 氯水和二氧化硫都能使品红溶液褪色 | |
| C. | 漂白粉长期暴露在空气中会变质 | |
| D. | 蔗糖中加入浓硫酸固体颜色变黑,说明浓硫酸具有吸水性 |
| A. | 氢氧化镁中滴加盐酸:H++OH-═H2O | |
| B. | 在硫酸氢钾溶液中加入氢氧化钡溶液至溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向次氯酸钠溶液中通入少量二氧化碳:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ |