题目内容
高锰酸钾(KMnO4)俗称灰锰氧,固体外观呈紫黑色,它具有杀菌、消毒之功效.实验室可由软锰矿(主要成分为MnO2)制备KMnO4,其反应中反应物与生成物有:MnO2、KOH、KClO3、K2MnO4、H2O和一种未知物X;然后将固体混合物用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩溶液,结晶得到深紫色的针状KMnO4.已知 0.2mol在反应中转移1.2mol 电子.试回答:
(1)由软锰矿(主要成分为MnO2)制备KMnO4反应中,还原产物是
(2)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:

(3).K2MnO4制备KMnO4的离子方程式是 ;
(4).H2O2在医疗上也是一种很好的消毒剂,它具有杀菌、消毒之功效.用酸性高锰酸钾溶液滴定法可测定双氧水中H2O2的含量,有两位同学分别用以下化学方程式表示其中的反应原理:
①5H2O2+2KMnO4+3H2SO4→2MnSO4+K2SO4+5O2↑+8H2O
②3H2O2+2KMnO4+3H2SO4→2MnSO4+K2SO4+4O2↑+6H2O
你认为其中错误的是 (认为没有可以不填),等物质的量的H2O2和KMnO4两种物质进行杀菌消毒时,H2O2的杀菌功效是KMnO4杀菌功效的 倍.
(1)由软锰矿(主要成分为MnO2)制备KMnO4反应中,还原产物是
(2)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:

(3).K2MnO4制备KMnO4的离子方程式是
(4).H2O2在医疗上也是一种很好的消毒剂,它具有杀菌、消毒之功效.用酸性高锰酸钾溶液滴定法可测定双氧水中H2O2的含量,有两位同学分别用以下化学方程式表示其中的反应原理:
①5H2O2+2KMnO4+3H2SO4→2MnSO4+K2SO4+5O2↑+8H2O
②3H2O2+2KMnO4+3H2SO4→2MnSO4+K2SO4+4O2↑+6H2O
你认为其中错误的是
考点:氧化还原反应的计算,氧化还原反应
专题:氧化还原反应专题
分析:(1)由MnO2制备KMnO4,Mn元素被氧化,而氧化剂应为KClO3,被还原生成KCl;
(2)反应中MnO2被氧化生成K2MnO4,Mn元素化合价由+4价升高到+6价,Cl元素化合价由+5价降低到-1价,结合电子转移属性相等判断;
(3)由题意可知酸性条件下K2MnO4转变为MnO2和KMnO4,以此书写反应的离子方程式;
(4)3H2O2中O元素化合价为-1价,结合电子得失相等计算.
(2)反应中MnO2被氧化生成K2MnO4,Mn元素化合价由+4价升高到+6价,Cl元素化合价由+5价降低到-1价,结合电子转移属性相等判断;
(3)由题意可知酸性条件下K2MnO4转变为MnO2和KMnO4,以此书写反应的离子方程式;
(4)3H2O2中O元素化合价为-1价,结合电子得失相等计算.
解答:
解:(1)由MnO2制备KMnO4,Mn元素被氧化,而氧化剂应为KClO3,被还原生成KCl,产物为KCl,该反应为6KOH+KClO3+3MnO2═3K2MnO4+KCl+3H2O,
故答案为:KCl;
(2)反应中MnO2被氧化生成K2MnO4,Mn元素化合价由+4价升高到+6价,Cl元素化合价由+5价降低到-1价,氧化剂和还原剂之间电子转移方向和数目可表示为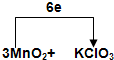 ,
,
故答案为: ;
;
(3)酸性条件下K2MnO4转变为MnO2和KMnO4,反应的离子方程式为3MnO42-+4H+=2 MnO4-+MnO2+2H2O,
故答案为:3MnO42-+4H+=2 MnO4-+MnO2+2H2O;
(4)3H2O2中O元素化合价为-1价,则2molKMnO4参加反应生成MnSO4,应得到10mol电子,则应生成5molO2,则②错误;
等物质的量的H2O2和KMnO4两种物质进行杀菌消毒时,二者都表现为氧化性,其中H2O2被还原生成水,1molH2O2可得2mol电子,而1mol可得5molKMnO4电子,则H2O2的杀菌功效是KMnO4杀菌功效的
=0.4倍
故答案为:②;0.4.
故答案为:KCl;
(2)反应中MnO2被氧化生成K2MnO4,Mn元素化合价由+4价升高到+6价,Cl元素化合价由+5价降低到-1价,氧化剂和还原剂之间电子转移方向和数目可表示为
 ,
,故答案为:
 ;
;(3)酸性条件下K2MnO4转变为MnO2和KMnO4,反应的离子方程式为3MnO42-+4H+=2 MnO4-+MnO2+2H2O,
故答案为:3MnO42-+4H+=2 MnO4-+MnO2+2H2O;
(4)3H2O2中O元素化合价为-1价,则2molKMnO4参加反应生成MnSO4,应得到10mol电子,则应生成5molO2,则②错误;
等物质的量的H2O2和KMnO4两种物质进行杀菌消毒时,二者都表现为氧化性,其中H2O2被还原生成水,1molH2O2可得2mol电子,而1mol可得5molKMnO4电子,则H2O2的杀菌功效是KMnO4杀菌功效的
| 2 |
| 5 |
故答案为:②;0.4.
点评:本题考查氧化还原反应及其计算,明确发生的反应及反应中元素的化合价变化是解答的关键,注意(4)电子守恒的应用,题目难度中等.

练习册系列答案
相关题目
用铂作电极电解某金属氯化物MCln的水溶液,当阳极产生a mol气体时,阴极析出m g金属(无气体生成),则金属的相对原子质量是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
将少量的CO2通入下列溶液中,没有沉淀产生的是( )
| A、Ba(OH)2溶液 |
| B、澄清石灰水 |
| C、氯化钡溶液 |
| D、漂白粉溶液 |
在pH=1的溶液中,能大量共存的一组离子是( )
| A、Mg2+、Ca2+、HCO3-、NO3- |
| B、Al3+、NH4+、Br-、Cl- |
| C、K+、MnO4-、S2-、SO42- |
| D、Na+、K+、SiO32-、Cl- |
常温下关于0.1mol?L-1氯化铵溶液的说法错误的是( )
| A、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B、加入氨水至pH=7,c(NH4+)>c(C1-) |
| C、滴加浓盐酸可能有,c(NH4+)=c(H+) |
| D、加入少量CH3COONa固体,c(NH4+)减小 |
抗震救灾,众志成城.用于汶川震后防疫的众多消毒剂中,有一种高效消毒剂的主要成分为三氯异氰尿酸(C303N3C13),又称高氯精.下列有关高氯精的说法不正确的是( )
| A、高氯精由4种元素组成 |
| B、高氯精中C、O、N、Cl的原子个数比为1:l:1:1 |
| C、高氯精中C、N两种元素的质量比为12:14 |
| D、高氯精中氯元素的质量分数为25% |
 钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题: