题目内容
1.下列各组离子,在所给的条件下一定能够大量共存的是( )| A. | 在pH=0的溶液中:Fe2+、Mg2+、SO42-、Cl- | |
| B. | 由水电离出的c(H+)=1×10-12mol/L的溶液中:NH4+、K+、Na+、NO3一 | |
| C. | 在A1C13溶液中:SO32-、Na+、CO32-、AlO2- | |
| D. | 在滴加石蕊试液后呈红色的溶液中:I一、Na+、S2-、AlO2- |
分析 A.该溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
B.该溶液中存在大量氢离子、氢氧根离子,铵根离子与氢氧根离子反应;
C.铝离子与亚硫酸根离子、碳酸根离子、平硫酸根离子反应;
D.该溶液中存在大量离子,氢离子与硫离子、偏铝酸根离子反应.
解答 解:A.在pH=0的溶液呈酸性,溶液中存在大量氢离子,Fe2+、Mg2+、SO42-、Cl-之间不发生反应,都不与氢离子反应,在溶液中能够大量共存,故A正确;
B.由水电离出的c(H+)=1×10-12mol/L的溶液呈酸性或强碱性,NH4+与氢氧根离子反应,在碱性溶液中不能大量共存,故B错误;
C.铝离子与SO32-、CO32-、AlO2-发生双水解反应,在溶液中不能大量共存,故C错误;
D.在滴加石蕊试液后呈红色的溶液呈酸性,S2-、AlO2-与酸性溶液中的氢离子反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
2.下列对聚丙烯的描述,错误的是( )
| A. | 聚丙烯的分子长链是由C-C键连接而成的 | |
| B. | 聚丙烯的分子长链上有支链 | |
| C. | 聚丙烯的结构简式为 | |
| D. | 等质量的聚丙烯和丙烯充分燃烧时,耗氧量:前者大于后者 |
12.100mL 6mol•L-1的 H2SO4溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
①Na2CO3溶液 ②水 ③K2SO4溶液 ④CH3COONa 溶液 ⑤Na2SO4固体 ⑥NaNO3溶液.
①Na2CO3溶液 ②水 ③K2SO4溶液 ④CH3COONa 溶液 ⑤Na2SO4固体 ⑥NaNO3溶液.
| A. | ①②③ | B. | ③④⑥ | C. | ①②④ | D. | ②③④ |
9.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是( )
①太阳能 ②核能 ③煤 ④氢能 ⑤地热能 ⑥天然气 ⑦风能 ⑧石油.
①太阳能 ②核能 ③煤 ④氢能 ⑤地热能 ⑥天然气 ⑦风能 ⑧石油.
| A. | ④⑤⑥⑦⑧ | B. | ①②⑤⑦⑧ | C. | ②③⑥⑦⑧ | D. | ①②④⑤⑦ |
16.下列离子方程式正确的是( )
| A. | 烧碱溶液与小苏打溶液混合:OH-+HCO3-═H2O+CO32- | |
| B. | AlCl3溶液中滴入过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 向1molBa(OH)2溶液中加入0.5mol的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | |
| D. | 钠和水反应:Na+2H2O═Na++2OH-+H2↑ |
6. 已知NaCl的摩尔质量为Mg•mol-1,食盐晶体的密度为ρ•cm-3,若图中N+与邻近的C-的核间距离为acm,那么阿伏加德罗常数的值表示为( )
已知NaCl的摩尔质量为Mg•mol-1,食盐晶体的密度为ρ•cm-3,若图中N+与邻近的C-的核间距离为acm,那么阿伏加德罗常数的值表示为( )
 已知NaCl的摩尔质量为Mg•mol-1,食盐晶体的密度为ρ•cm-3,若图中N+与邻近的C-的核间距离为acm,那么阿伏加德罗常数的值表示为( )
已知NaCl的摩尔质量为Mg•mol-1,食盐晶体的密度为ρ•cm-3,若图中N+与邻近的C-的核间距离为acm,那么阿伏加德罗常数的值表示为( )| A. | 2Ma3ρ | B. | $\frac{M}{{a}^{3}ρ}$ | C. | $\frac{2M}{{a}^{3}ρ}$ | D. | $\frac{M}{2{a}^{3}ρ}$ |
13.下列各组物质中,互为同系物的是( )
| A. | CH3-CH=CH2和  | |
| B. |  和 和  | |
| C. |  和 和 | |
| D. | CH2=CH-CH=CH2和CH3-CH2-CH2-C≡CH |
10.关于下列图示的说法中,正确的是( )
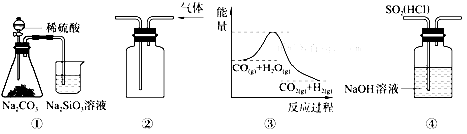

| A. | 图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集CO2气体 | |
| C. | 图③表示可逆反应CO(g)+H 2O (g)?CO2(g)+H2(g) 是吸热反应 | |
| D. | 图④装置可以用来除去SO2中的HCl |
11. 化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示.下列说法不正确的是 (相对原子质量 O-16)( )
化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示.下列说法不正确的是 (相对原子质量 O-16)( )
 化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示.下列说法不正确的是 (相对原子质量 O-16)( )
化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示.下列说法不正确的是 (相对原子质量 O-16)( )| A. | A为电源的正极 | |
| B. | 溶液中H+从阳极向阴极迁移 | |
| C. | Ag-Pt电极的电极反应式为2NO3-+12H++10e-═N2↑+6H2O | |
| D. | 电解过程中,每转移2 mol电子,则左侧电极就产生32gO2 |