��Ŀ����
�����ǹ�ҵ�ϳ��õĻ���ԭ��
��1����CH4Ϊԭ����ȡH2�ǹ�ҵ�ϳ��õ����ⷽ�����Ȼ�ѧ����ʽΪ��
CH4��g��+H2O��g���TCO��g��+3H2��g����H=+206.0kJ?mol-l��һ���¶��£���CH4��H2O��g����0.11mol����IL�����ܱ������У�
����ƽ��ʱѹǿ���ʼѹǿ��Ϊ21��11����ƽ��ʱH2��������� ��
�ڱ��������������䣬ֻ�ı�����������ʹH2���������������� ��
A��ʹ�ø�Ч���� B������He��g��������ѹǿ C�������¶� D�����������ٳ���1mol CO��3mol H2
�۱��������¶Ⱥ�������䣬��ʼͶ��CH4��H2O��g����CO��H2��Ϊ0.04mol��0.04mol��X��Y����ƽ��ʱ����������������ֲ��䣬��XΪ mol��YΪ mol��
�ڴ�����£���Ӧ��ʼ����_ ����������桱����Ӧ������У�
����֪��CH4��g��+2H2O��g��=CO2��g��+4H2��g����H=+165.0kJ?mol-l��д����CO2��CH4��Ӧ����CO��H2���Ȼ�ѧ����ʽ ��
��2���Լ��������Ϊȼ�ϣ�����������ҺΪ�������Һ���ɵ�أ������ĵ缫��ӦʽΪ ��
��1����CH4Ϊԭ����ȡH2�ǹ�ҵ�ϳ��õ����ⷽ�����Ȼ�ѧ����ʽΪ��
CH4��g��+H2O��g���TCO��g��+3H2��g����H=+206.0kJ?mol-l��һ���¶��£���CH4��H2O��g����0.11mol����IL�����ܱ������У�
����ƽ��ʱѹǿ���ʼѹǿ��Ϊ21��11����ƽ��ʱH2���������
�ڱ��������������䣬ֻ�ı�����������ʹH2����������������
A��ʹ�ø�Ч���� B������He��g��������ѹǿ C�������¶� D�����������ٳ���1mol CO��3mol H2
�۱��������¶Ⱥ�������䣬��ʼͶ��CH4��H2O��g����CO��H2��Ϊ0.04mol��0.04mol��X��Y����ƽ��ʱ����������������ֲ��䣬��XΪ
�ڴ�����£���Ӧ��ʼ����_
����֪��CH4��g��+2H2O��g��=CO2��g��+4H2��g����H=+165.0kJ?mol-l��д����CO2��CH4��Ӧ����CO��H2���Ȼ�ѧ����ʽ
��2���Լ��������Ϊȼ�ϣ�����������ҺΪ�������Һ���ɵ�أ������ĵ缫��ӦʽΪ
���㣺��ѧƽ���Ӱ������,�ø�˹���ɽ����йط�Ӧ�ȵļ���,��ѧ��Դ���͵��
ר�⣺��ѧ��Ӧ�е������仯,��ѧƽ��ר��,�绯ѧר��
��������1������������ʽ������������������ʱ�����ѹǿ֮�ȵ������ʵ���֮������ƽ��ʱ�������ʵ�����
��������������ԭ������ƽ���ƶ��ķ�����
�ۺ��º����£���ƽ��ʱ����������������ֲ��䣬��Ϊ��Чƽ�⣻
�ܸ�����֪�Ȼ�ѧ����ʽ�����ݸ�˹���ɽ��
��2������ȼ�ϵ���У������Ǽ�����ȼ�գ����Ի���������̼�����
��������������ԭ������ƽ���ƶ��ķ�����
�ۺ��º����£���ƽ��ʱ����������������ֲ��䣬��Ϊ��Чƽ�⣻
�ܸ�����֪�Ȼ�ѧ����ʽ�����ݸ�˹���ɽ��
��2������ȼ�ϵ���У������Ǽ�����ȼ�գ����Ի���������̼�����
���
�⣺��1����CH4��g��+H2O��g���TCO��g��+3H2��g��
��ʼ��mol�� 0.11 0.11 0 0
ת����mol�� x x x 3x
ƽ�⣨mol��0.11-x 0.11-x x 3x
�����������ʱ�����ѹǿ֮�ȵ������ʵ���֮�ȣ���
=21��11��x=0.1��
����ƽ��ʱ�������������Ϊ
��100%=71.4%��
�ʴ�Ϊ��71.4%��
��A��������Ӱ��ƽ���ƶ�����A����
B�����뺤������ѹǿ��ƽ�ⲻ�����ƶ�����B����
C�������¶�ƽ�������ȵ������ƶ��������������������C��ȷ��
D���ٳ���1mol CO��3mol H2������ѹǿ����ƽ�������������С�������ƶ����������������С����D����
��ѡC��
�ۺ��º����£���ƽ��ʱ����������������ֲ��䣬��Ϊ��Чƽ�⣬��Ӧǰ�����������ͬ�����Ա�����ȫ��Ч����CO��������ȫת��Ϊ��Ӧ������ˮ��ΪΪ0.11mol����0.04mol+X=0.04mol+
=0.11����X=0.07mol��Y=0.21mol���ݢ���֪��ƽ��ʱ����ȸ����ʵ����ʵ����ֱ�Ϊ0.01mol��0.01mol��0.1mol0.3mol���ɼ���ʼʱƽ�������ƶ����ʴ�Ϊ��0.07��0.21������
����֪����1��CH4��g��+2H2O��g��=CO2��g��+4H2��g����H=+165.0kJ?mol-l����2��CH4��g��+H2O��g���TCO��g��+3H2��g����H=+206.0kJ?mol-l��
�ݸ�˹���ɣ�2����2-��1���ã�CO2��g��+CH4��g��=2CO��g��+2H2��g����H=+247.0 kJ?mol-1��
�ʴ�Ϊ��CO2��g��+CH4��g��=2CO��g��+2H2��g����H=+247.0 kJ?mol-1��
��2��������������ڼ��Ի���������̼��������������������Ӳμӷ�Ӧ����C�Ļ��ϼ۷�Ӧǰ-4�ۣ���Ӧ��+4��֪ÿmol����ʧ8mol���ӣ��ݵ���غ��ԭ���غ���ƽ��Ϊ��CH4-8 e-+10OH-=CO32-+7H2O���ʴ�Ϊ��CH4-8 e-+10OH-=CO32-+7H2O��
��ʼ��mol�� 0.11 0.11 0 0
ת����mol�� x x x 3x
ƽ�⣨mol��0.11-x 0.11-x x 3x
�����������ʱ�����ѹǿ֮�ȵ������ʵ���֮�ȣ���
| 0.11-x+0.11-x+x+3x |
| 0.11+0.11 |
����ƽ��ʱ�������������Ϊ
| 3��0.1 |
| 0.01+0.01+0.1+0.3 |
�ʴ�Ϊ��71.4%��
��A��������Ӱ��ƽ���ƶ�����A����
B�����뺤������ѹǿ��ƽ�ⲻ�����ƶ�����B����
C�������¶�ƽ�������ȵ������ƶ��������������������C��ȷ��
D���ٳ���1mol CO��3mol H2������ѹǿ����ƽ�������������С�������ƶ����������������С����D����
��ѡC��
�ۺ��º����£���ƽ��ʱ����������������ֲ��䣬��Ϊ��Чƽ�⣬��Ӧǰ�����������ͬ�����Ա�����ȫ��Ч����CO��������ȫת��Ϊ��Ӧ������ˮ��ΪΪ0.11mol����0.04mol+X=0.04mol+
| Y |
| 3 |
����֪����1��CH4��g��+2H2O��g��=CO2��g��+4H2��g����H=+165.0kJ?mol-l����2��CH4��g��+H2O��g���TCO��g��+3H2��g����H=+206.0kJ?mol-l��
�ݸ�˹���ɣ�2����2-��1���ã�CO2��g��+CH4��g��=2CO��g��+2H2��g����H=+247.0 kJ?mol-1��
�ʴ�Ϊ��CO2��g��+CH4��g��=2CO��g��+2H2��g����H=+247.0 kJ?mol-1��
��2��������������ڼ��Ի���������̼��������������������Ӳμӷ�Ӧ����C�Ļ��ϼ۷�Ӧǰ-4�ۣ���Ӧ��+4��֪ÿmol����ʧ8mol���ӣ��ݵ���غ��ԭ���غ���ƽ��Ϊ��CH4-8 e-+10OH-=CO32-+7H2O���ʴ�Ϊ��CH4-8 e-+10OH-=CO32-+7H2O��
���������⿼������������ʽ����ƽ����㡢ƽ���ƶ�����Чƽ��ļ��㡢��˹���ɡ��缫��Ӧʽ��д����Ŀ��ȴ��Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
���¶Ⱥ��ݻ�����������У�һ�������·������б仯��H2��g��?2H��g������̬��ԭ�ӣ�����H��0����������H2��Ũ�ȴ�0.1mol/L��Ϊ0.06mol/Lʱ����20�룬��ôH2��Ũ����0.06mol/L�½���0.036mol/Lʱ��ʱ�䣨������
| A��12�� | B�����ж� |
| C������12�� | D����12�� |
����˵����ȷ���ǣ�������
| A����״���£�22.4 L CO2��22.4 L H2SO4������ͬ�ķ����� |
| B����״���£�1mol�����͵����Ļ�����壨����ȣ������ԼΪ22.4 L |
| C��������32g O2����������NA�� |
| D��22.4 L���������ķ�����һ������11.2 L���������ķ����� |
2011��3��11�գ��ձ������˵�վ��Ϊ9.0������������ĺ�Х���𣬲������صĺ�й©����й©���к�������Ԫ�ص�-131�����йص�-131��
I���͵�-127��
I��˵����ȷ���ǣ�������
131 53 |
127 53 |
A��
| ||||
B��
| ||||
C��
| ||||
D��
|
��������AgNO3��Һ��30.1g±���ط�����Ӧ������42.6g���������±���صĻ�ѧʽ�ǣ�������
| A��KF | B��KBr |
| C��KCl | D��KI |
�����£��ú� 0.2mol NaOH����Һǡ������0.2mol NO2���1L��Һ����Ӧ�Ļ�ѧ����ʽΪ��2NO2+2NaOH��NaNO3+NaNO2+H2O���Է�Ӧ�����Һ������˵����ȷ���ǣ���֪��Ka��HNO2��=7.1��10-4��Ka��CH3COOH��=1.7��10-5����������
| A��n��NO2-��+n��OH-��-n��H+��=0.1 mol |
| B����ͨ��0.01 mol HCl���壬��ҺpH����2��������Һ����ı仯�� |
| C������������CH3COONa���壬��Һ�ļ��Ի���� |
| D����ʱ��Һ��pH����0.1 mol/L��CH3COONa��Һ |
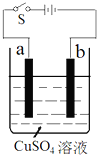 ��ͼ�ǵ�⾫��ͭ��װ��ʾ��ͼ���ش��������⣺
��ͼ�ǵ�⾫��ͭ��װ��ʾ��ͼ���ش��������⣺