题目内容
18. (1)已知:O2 (g)═O2+ (g)+e-△H1=+1175.7kJ•mol-1
(1)已知:O2 (g)═O2+ (g)+e-△H1=+1175.7kJ•mol-1PtF6(g)+e-═PtF6-(g)△H2=-771.1kJ•mol-1
O2+PtF6-(s)═O2+(g)+PtF6-(g)△H3=+482.2kJ•mol-1
则反应:O2(g)+PtF6(g)═O2+PtF6-(s)的△H=-77.6 kJ•mol-1.
(2)如图为合成氨反应在使用相同的催化剂,不同温度和压强条件下进行反 应,初始时N2和H2的体积比为1:3时的平衡混合物中氨的体积分数:
①在一定的温度下,向体积不变的密闭容器中充入氮气和氢气发生上述反应,下列能说明反应达到平衡状态的是ad.
a.体系的压强保持不变
b.混合气体的密度保持不变
c.N2和H2的体积比为1:3
d.混合气体的平均摩尔质量不变
②分别用vA(NH3)和vB(NH3)表示从反应开始到平衡状态A、B时的反应速率,则vA(NH3)< vB(NH3)(填“>”、“<”或“=”),该反应的平衡常数kA> kB(填“>”、“<”或“=”),在250℃、1.0×104kPa下达到平衡,H2的转化率为66.7%(计算结果保留小数点后一位);
(3)25℃时,将a mol NH4NO3溶于水,溶液呈酸性,原因NH4++H2O?NH3•H2O+H+(用离子方程式表示).向该溶液中加入bL氨水后溶液呈中性,则所加氨水的浓度为$\frac{a}{200b}$mol/L(用含a、b的代数式表示,NH3•H2O的电离平衡常数为Kb=2×10-5)
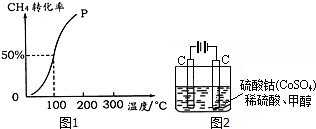
(4)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜.电镀一段时间后,装置Ⅰ中溶液的pH变小(填“变大”、“变小”或“不变”),a极电极反应方程式为CH4-8e-+10OH-=CO32-+7H2O;若电镀结束后,发现装置Ⅱ中阴极质量变化了25.6g(溶液中硫酸铜有剩余),则装置Ⅰ中理论上消耗甲烷2.24L(标准状况下).
分析 (1)利用盖斯定律解答,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得;
(2)①达到化学平衡状态时,正逆反应速率相等,各个组分的浓度不随时间的改变而改变,据此确定是否达到平衡;
②增大压强,化学反应速率加快,根据体积分数结合三行式计算即可;
(3)NH4NO3溶于水,铵根离子水解导致溶液呈酸性,即NH4++H2O?NH3•H2O+H+,c(NH4+)=c(3)铵根离子水解导致溶液显示酸性,根据溶液中的电荷守恒结合溶液显示中性的条件以及电离平衡常数表达式来计算;
(4)甲烷碱性燃料电池中,消耗氢氧化钾,铁棒上镀铜,阴极上的电极反应是:Cu2++2e-=Cu,根据电极反应结合电子守恒来计算.
解答 解:(1)已知:①O2(g)=O2+(g)+e-△H1=+1175.7kJ•mol-1
②PtF6(g)+e-=PtF6-(g)△H2=-771.1kJ•mol-1
③O2+PtF6-(s)=O2+(g)+PtF6-(g)△H3=+482.2kJ•mol-1
反应O2(g)+PtF6(g)=O2+PtF6-(s)可以是①+②-③得到,该反应的焓变△H=(+1175.7kJ•mol-1)+(-771.1kJ•mol-1)-482.2kJ•mol-1=-77.6kJ•mol-1,
故答案为:O2(g)+PtF6(g)=O2+PtF6-(s)△H=-77.6kJ•mol-1;
(2)①a.氮气氢气合成氨气的反应是反应前后系数和减小的反应,体系的压强保持不变,证明达到了平衡状态,故a正确;
b、混合气体的质量在前后是守恒的,体积不变,密度始终保持不变,所以密度不变化学反应不一定平衡,故b错误;
c、N2和H2的体积比为1:3,化学反应不一定平衡,故c错误;
d.混合气体质量前后是守恒的,物质的量变化,所以混合气体的平均摩尔质量会变化,当M不变,证明达到了平衡,故d正确.
故选:a d;
②增大压强,化学反应速率加快,根据图示内容知道,B的压强较大,所以vA(NH3)<vB(NH3),合成氨的反应是放热的,所以温度升高,速率加快,反应的平衡常数减小,因为A点温度低,所以kA>kB,在250℃、1.0×104kPa下达到平衡,氨气的体积分数是50%,则设N2的转化量为x,
N2+3H2?2NH3,
初始量:1 3 0
变化量:x 3x 2x
平衡量:1-x 3-3x 2x
$\frac{2x}{1-x+3-3x+2x}$=50%,解得x=$\frac{2}{3}$,所以氢气的转化率为:$\frac{3×\frac{2}{3}}{3}$×100%=66.7%,故答案为:<;>;66.7.
(3)NH4NO3溶于水,铵根离子水解导致溶液呈酸性,即NH4++H2O?NH3•H2O+H+,c(NH4+)=c(NO3-)=$\frac{a}{b}$mol/L,氨水的Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=2.0×10-5,
当溶液显示中性时,c(OH-)=10-7mol/L,所以$\frac{a}{200b}$mol/L,故答案为:$\frac{a}{200b}$;
(4)甲烷燃料电池中,消耗氢氧化钾,所以pH变小,装置Ⅱ中实现铁棒上镀铜,阴极上的电极反应是:Cu2++2e-=Cu,质量变化了25.6g即生成铜0.4mol,则电子转移了0.8mol,装置Ⅰ燃料做负极,负极a极反应为:CH4-8e-+10OH-=CO32-+7H2O,转移0.8mol电子,会消耗甲烷0.1mol,即2.24L,
故答案为:变小;CH4-8e-+10OH-=CO32-+7H2O;2.24.
点评 本题涉及电化学、热化学、化学反应速率和平衡的影响因素等知识,注意知识的归纳和整理是关键,综合性强,难度大.

 星级口算天天练系列答案
星级口算天天练系列答案| A. | 标准状况下22.4L Cl2与足量NaOH溶液反应生成NaCl和NaClO,转移电子数为Na | |
| B. | 16g甲烷中含有的非极性共价键键数为4Na | |
| C. | 一定两点额SO2溶于水后形成pH为2的水溶液,其中H+的数目为0.01Na | |
| D. | 1.8gD2O中含有的质子数为2Na |
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | ------ |
(1)铝热反应是氧化还原反应,在反应中金属被氧化(填“氧化”或“还原”).
(2)某同学根据以上数据推测,铝热反应所得到的熔融物中应含有铁、铝两种金属.如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为NaOH溶液,可观察到的实验现象为:有无色气体放出.
(3)实验室欲溶解此熔融物,下列试剂中最好的是B(填序号).
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.NaOH溶液.
| A. | 加入少量NaOH固体,c(CH3COO-)减小 | |
| B. | 加入少量FeCl3固体,c(CH3COO-)减小 | |
| C. | 稀释溶液,溶液的pH增大 | |
| D. | 加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
 完成下列各题:
完成下列各题:(1)已知下列反应的热化学方程式:
①6C (s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1;
②2H2(g)+O2 (g)=2H2O(g)△H2;
③C(s)+O2(g)═CO2(g)△H3.
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为12△H3+5△H2-2△H1.
(2)向体积为10L的恒容密闭容器中通入3mol X,在一定温度下发生如下反应:2X(g)?Y(g)+az(g),经5min后反应达到反应限度(即达到平衡状态).
①平衡时,测得容器内的压强为起始时的1.2倍,此时X的物质的量浓度为0.24mol•L-1,则方程式中a=3;用Y表示的反应速率为0.006mol•L-1•min-1.
②若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一时间内测得容器内的反应速率如表所示:
| 容器 | 反应速率 | 容器 | 反应速率 |
| 甲 | v(X)=3.5mol•L-1•min-1 | 乙 | v(Y)=2 mol•L-1•min-1 |
| 丙 | v(Z)=4.5mol•L-1•min-1 | 丁 | v(X)=0.075mol•L-1•s-1 |
(3)高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.
①则阳极的电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O;
②若隔膜为阴离子交换膜,则OH-自左向右移动(填左、右):
③假设电解前后体积变化忽略不计,撤去隔膜混合后,与原溶液比较pH降低(升高、降低或不变)

| A. | K1闭合,铁棒上发生的反应为2H++2e-→H2↑ | |
| B. | K1闭合,石墨棒周围溶液pH逐渐降低 | |
| C. | K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法 | |
| D. | K2闭合,电路中通过0.4NA个电子时,两极共产生4.48L气体 |