题目内容
8.如图所示的装置,X、Y都是惰性电极.将电路接通后,向(乙)中滴人酚酞溶液,在Fe极附近显红色.试回答下列问题:
(1)(甲)装置是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,b处电极上发生的电极反应式是O2+2H2O+4e-=4OH-;
(2)如果(丙)装置中精铜电极的质量增加了 6.4g,则乙装置中,铁电极上产生的气体在标准状况下为2.24LL,
(3)(丁)装置中Y电极上发生的电极反应式是Cu2++2e-=Cu.
分析 (1)电解饱和食盐水时,酚酞变红的极是阴极,阴极和电源负极相连,则在Fe极附近显红色,所以Fe是阴极,据此确定其他电极名称;
(2)根据串联电路中转移电子是相等的电子守恒规律来计算即可;
(3)Y为阴极,得电子发生还原反应.
解答 解:(1)电解饱和食盐水时,酚酞变红的极是阴极,阴极和电源负极相连,则在Fe极附近显红色,所以Fe是阴极,a是负极、b是正极,C是阳极,铁是阴极,b极氧气得电子发生还原反应,电极方程式为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(2)乙装置中精铜电极的质量增加了6.4g,根据电极反应:Cu2++2e-=Cu,即生成6.4g即0.1mol铜,转移电子是0.2mol,铁电极是阴极,该极上产生氢气,2H++2e-=H2↑,当转移0.2mol电子时,该极上产生的气体为0.1mol,在标准状况下体积为2.24L,故答案为:2.24;
(3))(丁)装置中Y为阴极,得电子发生还原反应,电极上发生的电极反应式是Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu
点评 本题以电解池原理为载体考查了正负极的判断、电极反应式的书写等知识点,难度中等,明确溶液中离子的放电顺序是解本题的关键.

练习册系列答案
相关题目
7.如图为冰的一种骨架形式,依此为单位向空间延伸,请问该冰中的每个水分子有几个氢键( )

| A. | 2 | B. | 4 | C. | 8 | D. | 12 |
13.下列说法中正确的是( )
| A. | 放热反应不一定不需要加热,但吸热反应一定需要加热 | |
| B. | 中和反应都是放热反应 | |
| C. | 氢气燃烧放出大量的热,说明参加反应的氢气和氧气总能量比生成物水的总能量低 | |
| D. | C与CO2反应是吸热反应 |
20.已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )
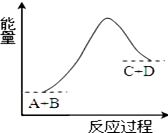

| A. | 该反应只有在加热条件下才能进行 | |
| B. | 该反应中D的能量可能大于反应物A和B的能量之和 | |
| C. | 该反应为放热反应 | |
| D. | 反应物的总能量高于生成物的总能量 |
18.下列有机分子中,所有的原子不可能处于同一平面的是( )
| A. | CH3-CH2-C≡CH | B. | CH2=CH-CH=CH2 | C. |  | D. |  |
 乙二醛电解氧化制备乙醛酸(OHC-COOH)的生产装置如图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸.
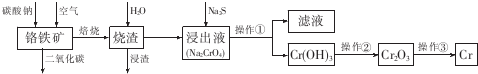
乙二醛电解氧化制备乙醛酸(OHC-COOH)的生产装置如图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸.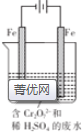 铬是极硬的银白色金属,主要用于冶炼各种合金钢和电镀.已知铬在自然界最重要的矿物是铬铁矿[Fe(CrO2)2或FeO.Cr2O3],工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程.
铬是极硬的银白色金属,主要用于冶炼各种合金钢和电镀.已知铬在自然界最重要的矿物是铬铁矿[Fe(CrO2)2或FeO.Cr2O3],工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程.